Research status and development of lithium carbonate thermal decomposition
-
摘要: Li2O广泛应用于化工、原子能工业、冶金等领域,Li2CO3作为最常见的制备Li2O的原料,研究Li2CO3热分解制备Li2O具有重要意义。基于此,文中阐述了Li2CO3真空热分解制备Li2O、常压下加入Al2O3促进Li2CO3热分解、真空下加入Al2O3促进Li2CO3热分解3种方法,并进行了详细的热力学分析,为Li2CO3热分解行为提供数据,介绍了当前国内外Li2CO3热分解研究现状及发展。指出了真空制备Li2O的优势,为Li2O制备工艺选择提供参考。Abstract: Li2O is widely used in the chemical industry, atomic energy industry, metallurgy and other fields. Li2CO3 is the most common raw material for preparing Li2O. The study on the thermal decomposition of Li2CO3 plays an important role in preparing Li2O. This paper explored the thermal decomposition of Li2CO3under vacuum, the addition of alumina to promote the thermal decomposition of Li2CO3 at normal pressure and vacuum conditons, respectively. From the methods above, the detailed thermodynamic analysis provided relevant data for the thermal decomposition behavior of Li2CO3. Moreover, this paper introduced the current research status and development of the thermal decomposition of Li2CO3 worldwide. The advantages of vacuum preparation of Li2O were noted for future research, which provides a reference for selecting Li2O preparation processes.
-
Keywords:
- Li2CO3 /
- Li2O /
- vacuum thermal decomposition
-
近年来,工业废水的排放、农业点源面源的长期污染使得地表水受到污染,众多城市的水源水多为微污染的水库、湖泊水[1].微污染水指的是受到轻微污染的水体,这类水体部分水质指标超过地表水环境质量标准(GB3838-2002)Ⅲ类水体标准,经过处理后能用作饮用水[2].微污染水中通常含有以下物质[3]:有机物、悬浮物、油类、无机物、腐植酸、重金属有毒物质、臭味、热污染、放射性物质、发泡物质等.对于微污染水源水的处理,国内外进行了大量的研究与实践,主要有强化处理技术[4-6]、预处理技术及深度处理技术[7],并且在饮用水常规处理工艺基础上探究出多种新型高效的微污染水源水处理工艺[8-9].
预处理技术是将物理、化学、生物等方法应用于常规工艺处理之前,对原水中污染物进行初级去除,减轻常规工艺或者深度处理工艺的负荷,更好地发挥常规处理工艺的处理效果,改善出水水质,保障饮用水安全[10-11].预处理技术主要有化学氧化预处理[12-13]、吸附预处理和生物预处理等[14-17].本文采用高锰酸钾作为氧化剂,对赣南某水库原水进行预氧化-混凝处理[18-20].考察了预处理时间、药剂投加量及pH值对预氧化-混凝处理微污染水源水效果的影响,确定了高锰酸钾预处理的最佳条件,并在此条件下测得预氧化-混凝对微污染水源水浊度、CODMn、UV254、铁、氨氮和锰的去除效果.
1 实验材料与方法
1.1 药剂与设备
实验药剂:聚合氯化铝(PAC)、高锰酸钾(KMnO4)、盐酸、硫酸、氢氧化钠等(均为分析纯);
主要仪器设备:梅宇牌SC2000-6型混凝搅拌器、哈希1900C浊度仪、雷磁pHs-3C pH计、W201水浴锅、WFZ-UV-2100紫外分光光度计等.
1.2 实验方法
取原水1 L,投加一定量预处理剂和混凝剂,置于磁力搅拌器上,反应后静止沉淀30 min于液面下2 cm处取样检测其浊度、pH值、CODMn、UV254、铁、氨氮和锰的含量.以浊度、CODMn、UV254[21-22]、铁、氨氮和锰的去除率为指标,研究预氧化时间、药剂投加量、pH值对处理效果的影响,并确定最佳操作参数.分析项目和测定方法见表 1.
表 1 分析项目及测定方法分析项目 测定方法 pH 雷磁pH s-3C pH计 浊度 哈希1900C浊度仪 CODMn 高锰酸盐指数法 UV254 分光光度法 铁 邻菲罗啉分光光度法 氨氮 纳氏试剂光度法 锰 高碘酸钾氧化光度法 实验基准条件:根据前期实验确定基本水力条件为混合搅拌强度260 r/min,搅拌时间2 min,絮凝搅拌强度80 r/min,搅拌时间25 min.根据前期实验选用PAC为混凝剂,其最佳投加量为10 mg/L,pH值为原水值.
在水厂构筑物设计中,絮凝阶段平均G值控制在20~70 s-1的范围内,平均GT值控制在1×104~1×105范围内,本实验中平均G值为60 s-1,平均GT值为66 546,满足设计要求[1].
在上述实验基准条件下进行单独强化混凝试验,原水各项指标的去除率见表 2.
表 2 单独混凝实验各指标去除率混凝剂 投加量/(mg·L-1) 余铝量/(mg·L-1) pH值改变 去除率/% 浊度 CODMn UV254 氨氮 铁 锰 PAC 10 0.09 0.32 98.87 60.70 68.28 40.10 95.10 35.89 由表 2知,微污染原水各污染物已部分去除,静置沉降后浊度在1NTU以下,CODMn、UV254、氨氮、铁、锰等污染指标得到一定程度的去除.但氨氮、锰的去除效果不佳,静置后水中氨氮含量为0.56 mg/L,锰含量为0.51 mg/L,均高于《生活饮用水卫生标准》(GB5749-2006)要求.采用预氧化-混凝进行处理,以强化对水中浊度、CODMn、UV254、铁的去除,提高氨氮、锰的去除率[1].
2 结果与讨论
实验水样为赣南某县水库水,水质分析见表 3.
表 3 原水水质分析项目名称 含量 浊度 35.5~46.9 NTU pH 7.3~7.9 CODMn 2.50~7.60 mg/L UV254 0.050~0.120 cm-1 氨氮 0.40~1.90 mg/L 铁 0.70~0.84 mg/L 锰 0.60~0.80 mg/L 由表 3原水水质分析结果可知,该水库原水浊度较高,铁、锰及氨氮含量超过《地表水环境质量标准》Ⅲ类水体标准(GB3838-2002).
2.1 高锰酸钾投加点对处理效果的影响
在实验基准条件下,高锰酸钾投加量0.6 mg/L,高锰酸钾投加点分别为投加混凝剂前8 min、6 min、4 min、2 min、0 min及投加混凝剂后2 min,不同投加点下高锰酸钾对浊度去除效果见图 1,对CODMn、UV254、氨氮、铁、锰的去除效果见图 2(图 1和图 2中,预氧化剂投加点1、2、3、4、5、6分别表示:投加混凝剂后2 min投加预氧化剂和投加混凝剂前0 min、2 min、4 min、6 min、8 min).
由图 1可知,在混凝剂投加量一定时,浊度去除率随着投加点而变化,在投加点3(即投加混凝剂前2 min)去除率达到最高为99.02 %,沉淀后出水浊度均低于1 NTU,与单独投加混凝剂相比,出水浊度显著降低.高锰酸钾氧化水中的有机物及锰离子,使其与水中的胶体粒子形成絮体,有利于沉降.
由图 2可知,混凝剂投加量一定时,随着投加点的变化,处理后水中pH值相比原水值略有降低,因为高锰酸钾会与水中的Mn2+反应,生成Mn(OH)4和H+.CODMn、UV254、氨氮、铁、锰去除率也随着高锰酸钾预氧化时间的增加呈现先增加再减少的趋势.铁的去除效果最好,沉淀后出水中铁含量均在0.1 mg/L以下,达到饮用水( < 0.3 mg/L)标准,去除率为91.76 %~96.00 %;与单独混凝相比,锰的去除效果提高了48.42 %,沉淀后出水锰离子含量可降至0.12 mg/L,去除率为81.54 %,但没有达到饮用水( < 0.1 mg/L)标准.CODMn和UV254的去除率分别为53.46 %~66.15 %和46.00 %~58.00 %,CODMn去除效果略有提高,但UV254的去除效果比只用混凝法处理时降低了34.55 %.这是由于高锰酸钾把大分子有机物氧化成小分子有机物,不利于絮凝去除[22].氨氮去除率为-2.70 %~44.44 %,预氧化投加时间点为8 min时,氨氮含量高于原水,在高锰酸钾预氧化过程中,氨化作用使有机氮转化为氨氮,氨化作用速度大于硝化作用速度,从而氨氮含量高于原水[23].由以上结果可知,在预氧化投加时间点为投加混凝剂前2 min时,预氧化-混凝法对浊度、CODMn、UV254、氨氮、铁、锰的去除均取得较好效果,为最佳投加时间点.
2.2 高锰酸钾投加量对处理效果的影响
在实验基准条件下,高锰酸钾预氧化投加时间点为投加混凝剂前2 min,投加量分别为0.2 mg/L,0.6 mg/L,1.0 mg/L,1.4 mg/L,1.8 mg/L,2.2 mg/L.高锰酸钾用量对浊度、CODMn、UV254、氨氮、铁、锰的去除效果见图 3、图 4.
由图 3可知,预氧化时间一定时,随着高锰酸钾投加量的增加,浊度去除率呈现先增加后减少的趋势,沉淀后出水浊度在0.38~1.61 NTU之间,高锰酸钾投加量为1.0 mg/L时,沉淀后出水浊度去除率达到99.09 %.实验发现随着高锰酸钾投加量的增加,处理水颜色逐渐变深,呈浅紫色,当投加量大于1.4 mg/L时,沉淀后水的色度和浊度逐渐升高,可见需要控制高锰酸钾的投加量.
由图 4知,随着高锰酸钾投加量的增加,高锰酸钾与水中的Mn2+反应,生成Mn(OH)4和H+,使得出水pH值比原水值略有降低,与单独混凝相比变化不显著.CODMn、UV254、氨氮、铁、锰去除率随着高锰酸钾投加量的增加呈现先增加再减少的趋势.铁的去除率比较平稳,去除率在80.95 %~93.65 %之间;锰的去除率变化较为明显,去除率在-4.48 %~91.05 %之间,在投加量为1.0 mg/L时去除效果最佳,沉淀后出水锰含量为0.06 mg/L;当投加量为2.2 mg/L时,水中锰含量高于原水值,由于过量高锰酸钾在水中溶解,没有完全反应,使水中锰含量增加.CODMn的去除率随着投加量的增加先缓慢增长,后趋于平稳,比仅用混凝法提高了17.04 %,去除效果较好.UV254的去除率则呈现相反的趋势,当投加量高于1.0 mg/L时,去除率下降,由于絮凝反应去除的是大分子有机物,而过多的高锰酸钾会将大分子有机物氧化降解为小分子,不利于絮凝沉淀.氨氮的去除效果投加量影响较大,在投加量为0.2~1.0 mg/L时去除率逐渐上升,投加量继续增大时氨氮去除率反而随之迅速下降.可能是高锰酸钾在水溶液中含有多种化合价态,低价锰元素把水中其他形态的氮还原成氨氮,使沉淀后出水氨氮含量高于原水.由以上结果可知,在投加量为1.0 mg/L时,浊度、CODMn、UV254、氨氮、铁、锰的去除率均取得较好效果,为最佳投加量.
2.3 初始pH值对处理效果的影响
在实验基准条件下,高锰酸钾投加量1.0 mg/L,预氧化投加时间点为投加混凝剂前2 min时,分别调原水pH值约为5、6、7、8(原水7.9,不调节)、9、10(为方便描述和绘图,本节中pH值均记为整数).不同pH值下高锰酸钾对浊度、CODMn、UV254、氨氮、铁、锰去除效果见图 5、图 6.
由图 5知,在高锰酸钾投加量一定的情况下,随着初始pH值的增加,浊度去除率先增大,后降低.在酸性条件下浊度去除率较差,当pH值达到9时,除浊效果最好,沉淀后出水浊度为0.21 NTU,去除率为99.55 %.在pH值为10时除浊率下降,因此高锰酸钾除浊的最佳pH范围为8~9的碱性环境.
由图 6可知,在酸性及中性条件下处理后出水pH值略上升,碱性条件下处理后出水pH值略降低.这是因为在酸性及中性条件下,高锰酸钾氧化生成MnO2和OH-,使得pH值略有上升;在碱性条件下高锰酸钾与水中的Mn2+反应,生成Mn(OH)4和H+,使得pH值略降低.氨氮、铁、锰去除率随投加量的增加先增大后减小.铁的去除率比较平稳,在90.32 %~98.39 %之间,出水含铁量低,去除效果好;氨氮、锰在pH值为9时去除效果最佳,氨氮的去除率为43.4 %,锰的去除率为96.67 %;CODMn和UV254在中性环境下可取得较好的去除效果,在pH值为7时,最大去除率分别为75.32 %和62.26 %.由以上结果得知,在pH值为8时,可较好地去除水中的浊度、CODMn、UV254、氨氮、铁、锰,且对水厂实际运行较为方便,不需调节pH,节省了药剂费用,因此综合考虑选择原水pH值(7.9)为最佳pH值.
2.4 高锰酸钾预氧化机理
高锰酸钾具有强氧化性,属于过渡金属元素,在水中能以多种氧化还原形态存在,主要有Mn(Ⅱ)、Mn(Ⅲ)、Mn(Ⅳ)、Mn(Ⅴ)、Mn(Ⅵ)、Mn(Ⅶ)等化合价态,各价态间可以相互转化.研究发现高锰酸钾在强酸性环境中具有较强的氧化性,在微酸性、中性及弱碱性环境中氧化性相对较弱.对于饮用水的处理,高锰酸钾在中性环境中对有机物去除效果优于酸性环境,氧化生成的MnO2具有很好的絮凝吸附效果,助凝效果显著,相关反应式为:
$${\rm{Mn}}{{\rm{O}}_4}^ - + 2{{\rm{H}}_2}{\rm{O}} + 3{\rm{e}} = 4{\rm{O}}{{\rm{H}}^ - } + {\rm{Mn}}{{\rm{O}}_2}\;\;\;{\rm{E}} = 0.588{\rm{V}}$$ (1) 1)高锰酸钾氧化有机物机理.在饮用水处理中,高锰酸钾对含有不饱和键及特征官能团的烯烃、苯酚、醇类等有机物去除效果较佳.醇类化合物不易被高锰酸钾氧化,但也有一定的去除效果.这些有机物被高锰酸钾氧化后,有的完全氧化成水和二氧化碳,有的变成醇、醛等非“三致物质”,对水有较好的净化效果[24].
2)高锰酸钾氧化絮凝机理.天然水体中,有机物会吸附到悬浮颗粒物或胶体表面,悬浮颗粒物或胶体表面被覆有机膜后,不易被混凝去除.高锰酸钾的强氧化性可氧化有机膜,使悬浮颗粒物或胶体易于被絮凝剂吸附并生成胶体颗粒,从而达到去除浊度与有机物的目的.高锰酸钾去除水中Mn2+的反应式为:
$$3{\rm{M}}{{\rm{n}}^{2 + }} + 2{\rm{Mn}}{{\rm{O}}_4}^ - + 12{{\rm{H}}_2}{\rm{O}} = 5{\rm{Mn}}{\left( {{\rm{OH}}} \right)_4} + 4{{\rm{H}}^ + }$$ (2) 生成的Mn(OH)4具有羟基表面,可使很多物质生成桥键,具有吸附架桥作用.
高锰酸钾与水中有机物和Mn2+反应生成的新生态二氧化锰固体物质具有良好的表面活性和自由羟基,这是MnO2具有很强吸附特性的结构基础;二氧化锰具有巨大的比表面积,能形成大分子聚合物,通过化学及吸附作用,在胶粒之间起到架桥作用,使水中胶体更易于结合,强化了混凝剂的絮凝作用,助凝效果显著[25].
3 结论
1)在高锰酸钾投加点和投加量一定的情况下,初始pH值的改变对预氧化效果影响较大.分析实验数据得出高锰酸钾除浊的最佳pH值范围为8~9的碱性环境.CODMn和UV254在中性环境下可取得较好的去除效果.氨氮、锰在pH值为9时去除效果最佳,去除率分别为43.4 %和96.67 %;比单独混凝处理提高了3.3 %和60.78 %.综合考虑各项指标的去除率,选取原水pH值为初始pH值,对水厂实际运行较为方便,节省药剂费用.
2)在实验基准条件下,通过改变预氧化投药时间点、投加量、pH值,得出最佳处理条件为:预氧化剂投加时间点为投加混凝剂前2 min,投加量为1.0 mg/L,pH值为原水值.浊度、CODMn、UV254、氨氮、铁、锰的去除率分别为99.09 %、68.78 %、50.94 %、33.96 %、96.77 %、81.67 %.与单独使用PAC对混凝处理相比,CODMn、锰的去除效果分别提高了8 %、45.78 %;但UV254和氨氮的去除率分别降低了17.34 %和6.14 %,可见在原水pH值下高锰酸钾预氧化不利于这2种指标的去除.
3)通过对高锰酸钾预氧化机理的研究,高锰酸钾预氧化主要是将水中的有机物与Mn2+氧化生成具有吸附助凝作用的二氧化锰,对浊度、有机物及Mn2+有很好的去除效果.
-
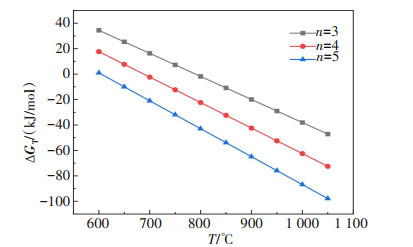
表 1 Li2CO3在不同压力下的初始反应温度
Table 1 Initial reaction temperature of Li2CO3 at different system pressures

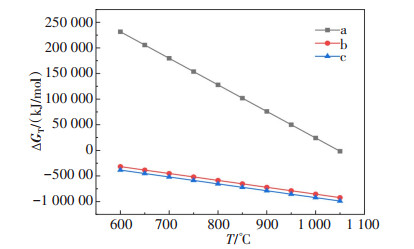
表 2 Li2CO3与Al2O3煅烧过程发生的反应及初始反应温度
Table 2 Reactions and initial reaction temperature during calcination of Li2CO3 and Al2O3

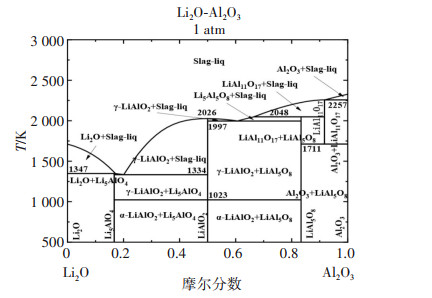
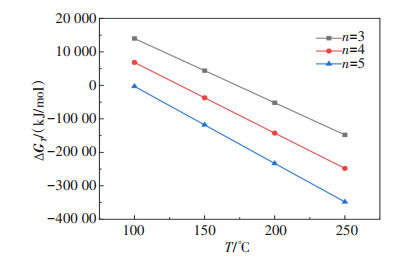
表 3 LiAlO2在不同压力下的反应初始温度
Table 3 Initial reaction temperature of LiAlO2 at different pressures

-
[1] 李良彬, 邓招男, 熊训满, 等. 一种高纯氧化锂的制备方法: CN102515211A[P]. 2012-06-27. [2] 姜小毛, 李芳芳. 我掌握高纯氧化锂制备新工艺——百吨级生产线建成投产[N]. 中国化工报, 2014-02-14(2). [3] 张朝纲, 李继东, 路金林, 等. 以氧化铝为骨料真空热分解碳酸锂的正交实验及动力学过程分析[J]. 材料与冶金学报, 2020, 19(3): 196-202. https://www.cnki.com.cn/Article/CJFDTOTAL-HUJI202003008.htm [4] 张江峰, 崔妍. 锂在新兴领域的应用[J]. 中国有色金属, 2021(7): 44-45. doi: 10.3969/j.issn.1673-3894.2021.07.009 [5] 胡国琛, 胡年香, 伍继君, 等. 锂离子电池正极材料中有价金属回收研究进展[J]. 中国有色金属学报, 2021, 31(11): 3320-3343. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXZ202111021.htm [6] 雷舒雅, 徐睿, 孙伟, 等. 废旧锂离子电池回收利用[J]. 中国有色金属学报, 2021, 31(11): 3303-3319. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXZ202111020.htm [7] 陈世贤, 苏昊, 戴曦. 失效锂离子电池正极材料管道化浸出工艺[J]. 有色金属科学与工程, 2022, 13(3): 89-98. doi: 10.13264/j.cnki.ysjskx.2022.03.012 [8] 乐志强, 薄胜民, 王光建. 无机精细化学品手册[M]. 北京: 化学工业出版社, 200l. [9] 杨风春. 氧化锂的研制[J]. 新疆有色金属, 1999, 22(3): 27-29, 32. https://www.cnki.com.cn/Article/CJFDTOTAL-XJYS199903008.htm [10] ANNO J N, BOEING H H. Method of producing porous lithium oxide: US4221775[P]. 1980-09-09.
[11] SALMON D J. High purity lithium oxide process: US4732751[P]. 1988-03-22.
[12] 姚文贵, 马鸿文, 刘梅堂, 等. 锂辉石水热钾碱分解制取碳酸锂相平衡模拟与优化试验[J]. 有色金属(冶炼部分), 2021(4): 28-35. https://www.cnki.com.cn/Article/CJFDTOTAL-METE202104005.htm [13] 李存增, 常华. 盐湖卤水提锂溶液制备碳酸锂试验[J]. 有色金属(冶炼部分), 2021(11): 75-78. https://www.cnki.com.cn/Article/CJFDTOTAL-METE202111013.htm [14] 汪发波, 王林生, 文小强. 碳化分解法提纯碳酸锂的研究[J]. 有色金属科学与工程, 2013, 4(2): 41-45. doi: 10.13264/j.cnki.ysjskx.2013.02.006 [15] 戴江洪, 王宏岩, 李平. 高纯碳酸锂制备研究进展[J]. 中国有色冶金, 2020, 49(1): 49-53. https://www.cnki.com.cn/Article/CJFDTOTAL-YSYL202001014.htm [16] 肖国光. 熔盐法制备氧化镁的反应机理及其动力学研究[D]. 南昌: 南昌大学, 2010. [17] 夏伟, 黄芳, 王梅, 等. 纳米级碳酸钙煅烧分解特性研究[J]. 江汉大学学报(自然科学版), 2019, 47(1): 12-17. https://www.cnki.com.cn/Article/CJFDTOTAL-WHZG201901002.htm [18] 卢尚青, 吴素芳. 碳酸钙热分解进展[J]. 化工学报, 2015, 66(8): 2895-2902. https://www.cnki.com.cn/Article/CJFDTOTAL-HGSZ201508019.htm [19] 施磊. 铝酸锂真空碳热还原制备金属锂的工艺研究[D]. 昆明: 昆明理工大学, 2020. [20] 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 449-479. [21] 狄跃忠, 彭建平, 王耀武, 等. 真空铝热还原LiAlO2制取金属锂的研究[J]. 真空科学与技术学报, 2012, 32(7): 588-592. https://www.cnki.com.cn/Article/CJFDTOTAL-ZKKX201207010.htm [22] ČANČAREVIČ, SCHÖN J C, JANSEN M. Alkali metal carbonates at high pressure[J]. Zeitschrift Für Anorganische Und Allgemeine Chemie, 2006, 632(8/9): 1437-1448.
[23] ČANČAREVIĆ Ž, SCHÖN J, JANSEN M. Possible existence of alkali metal orthocarbonates at high pressure[J]. Chemistry-A European Journal, 2007, 13(26): 7330-7348.
[24] KAPLAN V, WACHTEL E, LUBOMIRSKY I. Conditions of stability for (Li2CO3+Li2O) melts in air[J]. The Journal of Chemical Thermodynamics, 2011, 43(11): 1623-1627.
[25] KAPLAN V, WACHTEL E, LUBOMIRSKY I. CO2 to CO electrochemical conversion in molten Li2CO3 is stable with respect to sulfur contamination[J]. Journal of the Electrochemical Society, 2013, 161(1): 54-57.
[26] KAPLAN V, WACHTEL E, LUBOMIRSKY I. Titanium carbide coating of titanium by cathodic deposition from a carbonate melt[J]. Journal of the Electrochemical Society, 2012, 159(11): 159-161.
[27] DUAN Y H, SORESCU D C. Density functional theory studies of the structural, electronic, and phonon properties of Li2O and Li2CO3: Application to CO2 capture reaction[J]. Physical Review, B. Condensed Matter and Materials Physics, 2009, 79(1): 014301.
[28] KAPLAN V, WACHTEL E, GARTSMAN K, et al. Conversion of CO2 to CO by electrolysis of molten lithium carbonate[J]. Journal of the Electrochemical Society, 2010, 157(4): 552-556.
[29] MOSQUEDA H A, VAZQUEZ C, BOSCH P, et al. Chemical sorption of carbon dioxide (CO2) on lithium oxide (Li2O)[J]. Chemistry of Materials, 2006, 18(9): 2307-2310.
[30] ÁVALOS-RENDÓN T L, PFEIFFER H. High CO2 chemisorption in α-Li5AlO4 at low temperatures (30-80℃): effect of the water vapor addition[J]. Energy & Fuels, 2012, 26(5): 3110-3114.
[31] KONAR B, VAN ENDE M A, JUNG I H. Critical evaluation and thermodynamic optimization of the Li2O-Al2O3 and Li2O-MgO-Al2O3 systems[J]. Metallurgical and Materials Transactions B, 2018, 49(5): 2917-2944.
[32] 尤晶, 王耀武, 贺晓军. 碳酸锂煅烧制备氧化锂的工艺研究[J]. 轻金属, 2020(11): 4-6, 15. https://www.cnki.com.cn/Article/CJFDTOTAL-QJSS202011002.htm [33] 尤晶, 王耀武, 贺晓军. 镁锂混合氧化物的制备工艺研究[J]. 稀有金属与硬质合金, 2021, 49(1): 77-82. https://www.cnki.com.cn/Article/CJFDTOTAL-XYJY202101014.htm



 下载:
下载: