Study on the physicochemical properties of the LaCl3-KCl molten salt system
-
摘要: 合理选择熔盐体系在电解法制备稀土金属工业生产过程中至关重要。文中采用阿基米德法、拉筒法和连续变电导池常数法(CVCC)测定了不同配比的LaCl3-KCl熔盐在1 073~1 223 K下的密度、界面张力和电导率。结果表明,随着温度升高,相同成分的LaCl3-KCl熔盐的密度(ρ)和界面张力(σ)均呈降低趋势,而电导率(κ)逐渐增大;在相同温度下,随着LaCl3含量增加,LaCl3-KCl熔盐的密度和界面张力均逐渐增大,而电导率逐渐减小。通过拟合获得密度、界面张力以及电导率的经验公式分别为ρ=a-b×T×10-3、σ=a-b×T×10-3、κ=A+B×T×10-3+C×T2×10-6,明晰了熔盐的物化性质随温度及组分的变化规律,为熔盐电解法制备镧及其镧合金提供科学依据。Abstract: Reasonable selection of molten salt systems is crucial in the industrial production process of the rare earth metal industry prepared by electrolysis. The density, surface tension and conductivity of LaCl3-KCl molten salt of different ratios at 1 073—1 223 K were determined by the Archimedes method, tube pulling method and continuous variable conductivity cell constant method (CVCC). The results show that as the temperature increases, the density (ρ) and interface tension (σ) of the LaCl3-KCl molten salt of the same component decrease, while the conductivity (κ) gradually increases. At the same temperature, with increasing LaCl3 content in the molten salt, the density and interfacial tention increase, while the conductivity gradually decreases. The empirical formulas for density, interface tension and conductivity are, ρ=a-b×T×10-3, σ=a-b×T×10-3, κ=A+B×T×10-3+C×T2×10-6, respectively. The change law of the physicochemical properties of molten salt with temperature and components is clarified, which provides a scientific basis for the preparation of lanthanum and its alloys by molten salt electrolysis.
-
Keywords:
- density /
- interface tension /
- electrical conductivity /
- LaCl3-KCl /
- molten salt /
- empirical formula
-
金属镧广泛应用于制备贮氢材料、超导材料和磁制冷材料等[1],还可用于制备其他金属的还原剂。金属镧及其合金的制备方法主要有3种:金属热还原法、熔兑法、熔盐电解法。金属热还原法和熔兑法的生产成本高、工艺流程长、生产效率低;熔盐电解法可实现连续生产,具有工作流程短、成本低、生产效率高等优势[2-3],是制备镧及其合金的主流方法。在熔盐电解法制备金属镧及其合金过程中,电解温度、电解质组成及其物化性质是影响电解产物的重要因素。尤其是合理的电解质组成及其物化性质尤为关键,如熔盐的密度可影响电解产物的接收与分离;熔盐的界面张力关系到阳极气泡的逸出,影响电解质对阳极的润湿性,若界面张力大,电解质不能充分润湿阳极,会产生气膜层,造成阳极效应,以致发生弧光放电;熔盐电导率的研究有助于了解熔融盐的结构,对提高电流效率以及降低能耗具有重要意义[4]。根据熔盐体系的不同,熔盐电解法又可以细分为氟化物体系和氯化物体系[5-7]。目前,研究者已对熔盐的物化性质进行了大量研究,其中,LaCl3-KCl体系的研究多集中在二十世纪八九十年代,随着氟化物电解研究的迅速发展,目前研究较多的是熔盐氟化物体系[8-10],在前人研究的基础上,本研究改进一些实验条件,并对得到的密度和界面张力进行线性拟合、对得到的电导率进行曲线拟合,揭示了熔盐物化性质随温度及LaCl3含量的变化关系。系统研究LaCl3-KCl熔盐的物化性质对于补充熔盐体系相关数据,指导生产实际具有重要意义。
本研究分别采用阿基米德法、拉筒法和连续变电导池常数法(CVCC法)测定了不同的温度和LaCl3含量条件下LaCl3-KCl体系的密度、界面张力和电导率,通过拟合获得合理的经验公式,确定了物化性质随温度及组分的变化规律。得到的数据实验误差范围为2%~3%。
1 实验部分
1.1 仪器与试剂
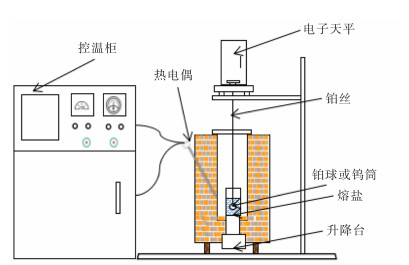
RT-5型熔盐物化综合测试仪,设备装置如图 1所示[11],控温柜设定温度,采用S型热电偶实时温度检测,热天平下悬挂铂丝,测量密度采用铂球,测量界面张力采用钨筒,测量电导率采用钼丝为工作电极,钨丝为参比电极。
实验所用的LaCl3、KCl为化学纯试剂(99.99%,上海麦克林生化科技公司)。在实验前将LaCl3和KCl放入马弗炉中进行脱水,200 ℃恒温2 h去除自由水,350 ℃恒温2 h去除其中的结晶水[10],密封好放在手套箱中备用。本研究的高温实验均在高纯氩气中进行,气流为500 mL/min。
1.2 实验方法
采用阿基米德法(流体静力学称量法)测量LaCl3-KCl的密度(ρ)。阿基米德原理是浸入液体中的物体受到向上的浮力,浮力大小等于物体排开液体受到的重力。将铂球系在铂丝上,悬挂在天平下端,铂球浸入熔盐前重量为M1,完全浸入熔盐后重量为M2,常温下标定铂球的体积为V,再根据铂球的热膨胀系数确定铂球在高温条件下体积为Vt,根据式(1)可求出熔盐密度:

(1) 采用拉筒法测量LaCl3-KCl的界面张力(σ),界面张力是液体表面层的质点受到一个指向液体内部的合力。因此,将钨筒系在铂丝上,悬挂在天平下端,缓慢下降直至钨筒完全接触液面,缓慢拉离钨筒,此时拉力越来越大,当钨筒拉离液面的瞬间,拉力达到最大值,与液面质点受到的合力相等,这个最大拉力即为熔盐的界面张力。最大拉力为Mmax,钨筒直径为r,F为纠错因子,g为重力加速度,根据式(2)[12-13]可求出熔盐界面张力:

(2) 采用连续改变电导池常数法(CVCC法)测量LaCl3-KCl的电导率,当一个恒电流通过导体时,导体的电流为I,电压为U,满足关系式I=GU(G为电导,单位为S)。电导与电阻呈倒数关系,即G=1/R。采用CVCC法测量电导率时,通过改变毛细管长度,测量长度变化前后的电阻值的变化(R1-R2),电导率与电导、导体截面积A及导体长度L满足式(3)[14]:

(3) 2 实验结果
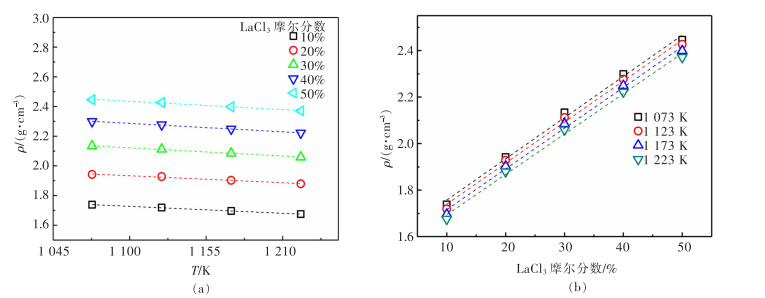
2.1 温度与成分对LaCl3-KCl密度的影响
在1 073~1 223 K下,采用阿基米德法测试LaCl3含量不同的LaCl3-KCl熔盐的密度。如图 2(a)所示,随着温度升高,LaCl3含量相同的LaCl3-KCl熔盐的密度随之减小,呈线性关系,这是由于温度升高,La3+、K+、Cl-的动能增大,运动剧烈,离子间距增大,使熔盐体积增大,因此密度减小。如图 2(b)所示,在相同温度下,随着LaCl3含量增加,LaCl3-KCl熔盐密度逐渐增大,这是由于K+的离子半径小于La3+,故K+动能较大,运动更剧烈,K+含量增大时,与其他带电粒子间距增大,体系的体积膨胀,密度减小。因此,随着LaCl3含量增加,KCl含量减少,体系密度逐渐增大。在文献[15]中,在900 ℃下,LaCl3-KCl体系的密度如表 1所列,其数值大于本研究在1 173 K测得的密度值,这可能是由于二十世纪九十年代测量密度采用的钼锤在高温下易氧化,导致体积减小,因此测得的密度偏大。本研究采用的是钨锤,在高温下抗氧化性强,测得的体积较准确。同时,徐光宪所著的《稀土》书中也记载了LaCl3-KCl密度[16],但测试温度为800~880 ℃;FUKUSHIMA等也对LaCl3-KCl体系的密度进行了研究[17],研究温度为750~870 ℃,均与本论文研究温度范围(800~950 ℃,即1 073~1 223 K)不同。
熔盐密度和温度的关系可用式(4)表示:

(4) 式(4)中:a、b为系数;T为热力学温度,K;ρ为熔盐密度,g/cm3。
对实验数据进行线性拟合,得到经验公式,如表 2所列,各经验公式拟合度较高(R2≥0.989),说明此经验公式可充分反映熔盐密度随着温度及组分的变化规律。
表 2 LaCI3-KCI熔盐体系的密度与温度(1 073~1 223K)的拟合方程Table 2. Fitting equation of density and temperature of LaCl3-KCl molten salt system (1 073~1 223 K)
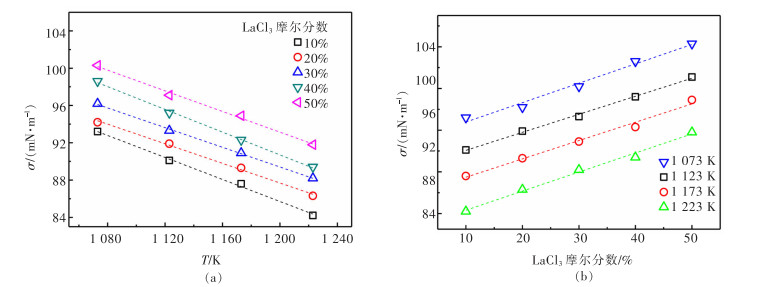
2.2 温度与成分对LaCl3-KCl界面张力的影响
在1 073~1 223 K下,采用拉筒法测试不同比例LaCl3-KCl熔盐的界面张力。如图 3(a)所示,随着温度升高,相同比例的LaCl3-KCl熔盐的界面张力呈线性减小,这是由于温度升高,熔盐中的离子运动更活跃,离子间距增大,离子间作用力减弱,因而体系的体积膨胀。同时,随着温度升高,熔盐中的LaCl3和KCl更易分解成离子,使界面张力增大,相比之下,界面张力的减小值远大于其增加值,因此,界面张力呈减小趋势。由图 3(b)可知,在相同温度下,随着LaCl3含量增加,界面张力逐渐增大,由于La3+的离子半径大于K+,在相同条件下,K+比La3+运动剧烈,因此,随着LaCl3的增多,离子间距减小,界面张力增大。与文献[15]中记载的900 ℃时LaCl3-KCl界面张力规律性一致(表 3),这可能是由于将钼筒或钨筒拉离熔盐表面时,会有一部分熔盐附着在钼/钨筒上,导致测得的数据偏大或偏小,但偏差较小,在误差允许的范围内。徐光宪所著的《稀土》中提到的界面张力测试温度范围为800~850 ℃[16],FUKUSHIMA等研究的界面张力温度范围为750~870 ℃[17],本研究的温度范围为800~950 ℃,因而对界面张力的数据起到良好的补充作用。
表 3 LaCl3-KCI体系表面张力(900 ℃)[15]Table 3. Surface tension of the LaCl3-KCl molten salt system (900 ℃)"15
熔盐的界面张力与温度呈线性关系,可用如下关系式表示[18]:

(5) 式(5)中:a、b为系数;T为热力学温度,K;σ为熔盐界面张力,mN/m。
对实验数据进行线性拟合,得到经验公式,如表 4所列,各经验公式拟合度较高(R2≥0.993),说明经验公式可充分反映熔盐界面张力随着温度及组分的变化规律。
表 4 LaCI3-KCI熔盐体系的界面张力与温度(1073~1 223 K)的拟合方程Table 4. Fitting equation of surface tension and temperature of LaCI3-KCl molten salt system(1 073~1 223 K)
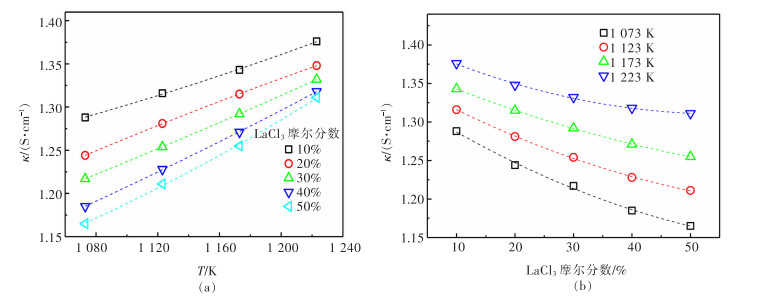
2.3 温度与成分对LaCl3-KCl电导率的影响
在1 073~1 223 K下, 采用CVCC法测试不同比例LaCl3-KCl熔盐的电导率。如图 4(a)所示,随着温度升高,电导率逐渐增大,这是由于温度升高使内部离子移动速率加快,同时熔盐中离子的热运动增强,动能增大,离子间的作用力减弱,电导率随之增大。由图 4(b)可知,随着LaCl3含量增加,熔盐体系熔点升高,黏度增大,离子的热运动受到限制;同时,由于LaCl3电导率大于KCl,LaCl3络合物颗粒较大,LaCl3含量增多也会阻碍离子的定向迁移。因此,随着LaCl3的增多,熔盐体系的电导率逐渐减小,见表 5。本研究的电导率数据对石富[15]及徐光宪[16]出版的书籍起到很好的补充作用。
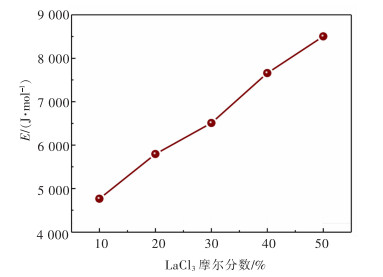
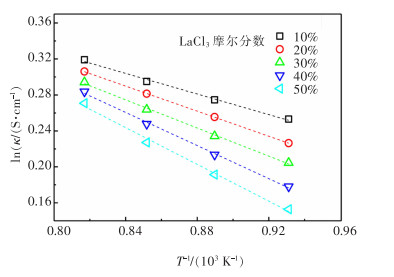
电导率随温度的变化通常满足阿伦尼乌斯公式,通过图 4电导率与温度的关系图绘制出电导率对数与温度倒数的拟合曲线(图 5),此曲线与阿伦尼乌斯曲线相符,阿伦尼乌斯公式[18]如下:

(6) 式(6)中:κ为熔盐电导率,S/cm;A为指前因子;E为熔盐电导活化能,J;R为气体常数,8.314 J/(K·mol);T为温度,K。
根据阿伦尼乌斯公式绘制出的熔盐电导率对数和温度倒数的拟合曲线,可得到熔盐体系的电导活化能(图 5)。如图 5所示,随着LaCl3含量增加,熔盐的电导活化能逐渐增大,这是由于增加LaCl3含量使熔盐黏度增大,离子运动受限,自由运动的离子数目减少,离子自由迁移的能量增大,使电导活化能增大。根据阿伦尼乌斯公式绘制出熔盐电导率对数和温度倒数的关系如图 6所示,计算可得到lnA和活化能E(表 6)。对实验数据进行一元二次方程拟合[19-20],得到电导率与温度的经验公式(式(7)),拟合度较高(R2≥0.997),说明此经验公式可准确反映熔盐电导率与LaCl3含量之间的关系。
表 6 电导活化能(E), 指前因子(InA)及经验公式的拟合度(R2)Table 6. Activation energy of the electrical conductivity (E) of melt, preexponential factor (InA), and degree of fitting of empirical formula (R2)
熔盐的电导率与温度可用如下关系式表示:

(7) 式(7)中:A、B、C为系数;T为热力学温度,K;κ为熔盐电导率,S/cm。
3 结论
1)随着温度升高,LaCl3-KCl熔盐体系的密度和界面张力均逐渐减小;在相同温度下,随着LaCl3含量增多,LaCl3-KCl熔盐体系的密度和界面张力均逐渐增大,对测得的密度和界面张力进行线性拟合,获得了密度、界面张力和温度及组分的经验公式和,此公式可准确反映熔盐密度、界面张力随温度及组分的变化规律。
2)通过对熔盐电导率数据进行一元二次方程拟合,得到拟合度较高的电导率和温度的经验公式。随着温度升高,LaCl3-KCl熔盐体系的电导率逐渐增大;在相同温度下,随着LaCl3含量增加,LaCl3-KCl熔盐体系的电导率逐渐降低。
-
表 2 LaCI3-KCI熔盐体系的密度与温度(1 073~1 223K)的拟合方程
Table 2 Fitting equation of density and temperature of LaCl3-KCl molten salt system (1 073~1 223 K)

表 3 LaCl3-KCI体系表面张力(900 ℃)[15]
Table 3 Surface tension of the LaCl3-KCl molten salt system (900 ℃)"15

表 4 LaCI3-KCI熔盐体系的界面张力与温度(1073~1 223 K)的拟合方程
Table 4 Fitting equation of surface tension and temperature of LaCI3-KCl molten salt system(1 073~1 223 K)

表 5 LaCI3-KCl体系的电导率(917 ℃)[15]
Table 5 Electrical conductivities of the LaCI3-KCl molten salt system(917 ℃)[15]

表 6 电导活化能(E), 指前因子(InA)及经验公式的拟合度(R2)
Table 6 Activation energy of the electrical conductivity (E) of melt, preexponential factor (InA), and degree of fitting of empirical formula (R2)

-
[1] 成维, 黄美松, 王志坚, 等. 金属镧的制备方法及应用研究现状[J]. 稀有金属与硬质合金, 2014, 42(1): 62-65. https://www.cnki.com.cn/Article/CJFDTOTAL-XYJY201401016.htm [2] YASUDA K, KOBAYASHI S, NOHIRA T, et al. Electrochemical formation of Dy-Ni alloys in molten NaCl-KCl-DyCl3[J]. Electrochimica Acta, 2013, 106: 293-300. doi: 10.1016/j.electacta.2013.05.095
[3] IIDA T, NOHIRA T, ITO Y. Electrochemical formation of Sm-Co alloy films by Li codeposition method in a molten LiCl-KCl-SmCl3 system[J]. Electrochimica Acta, 2003, 48(7): 901-906. doi: 10.1016/S0013-4686(02)00786-7
[4] 于兵, 康佳, 黄海涛, 等. 温度和钇含量对LiF-YF3-Y2O3电解质体系电导率的影响[J]. 有色金属工程, 2021, 11(3): 63-68. doi: 10.3969/j.issn.2095-1744.2021.03.010 [5] 廖春发, 蔡伯清, 王旭, 等. 熔盐电解制备镝合金及其电化学机理研究现状与发展趋势[J]. 稀有金属与硬质合金, 2018, 46(5): 18-23. https://www.cnki.com.cn/Article/CJFDTOTAL-XYJY201805005.htm [6] 冷欣伟, 汤浩, 廖春发, 等. 熔盐电解制备Al-Cu-Y合金电解质体系黏度的研究[J]. 有色金属科学与工程, 2019, 10(5): 8-11. doi: 10.13264/j.cnki.ysjskx.2019.05.002 [7] 蔡伯清. DyF3-LiF熔盐电解主体系物理化学性质研究[D]. 赣州: 江西理工大学, 2018. [8] 谢刚. 熔融盐理论与应用[M]. 北京: 冶金工业出版社, 1998. [9] 刘奎仁, 陈建设, 魏绪钧, 等. NdF3-LiF-Nd2O3系熔盐密度的研究[J]. 稀有金属与硬质合金, 2000, 28(4): 7-10. doi: 10.3969/j.issn.1004-0536.2000.04.002 [10] 任浩, 李继东, 王一雍, 等. CaCl2-CaF2-CaO-SiO2熔盐体系基础性质研究[J]. 有色金属(冶炼部分), 2017(3): 20-23. doi: 10.3969/j.issn.1007-7545.2017.03.005 [11] 康佳, 于兵, 黄海涛, 等. LiF-YF3-Y2O3体系密度与表面张力的研究[J]. 有色金属(冶炼部分), 2020(11): 89-94. https://www.cnki.com.cn/Article/CJFDTOTAL-METE202011016.htm [12] 邱竹贤. 铝电解原理与应用[M]. 徐州: 中国矿业大学出版社, 1998. [13] 许名湘. LaF3-LiF-La2O3系熔盐物理化学性质的研究[D]. 沈阳: 东北大学, 2014. [14] JONES G, CHRISTIAN S M. The measurement of the conductance of electrolytes. VI. galvanic polarization by alternating current[J]. Journal of the American Chemical Society, 1935, 57(2): 272-280. doi: 10.1021/ja01305a015
[15] 石富. 稀土冶金技术[M]. 北京: 冶金工业出版社, 2009. [16] 徐光宪. 稀土(上)[M]. 2版. 北京: 冶金工业出版社, 1995. [17] FUKUSHIMA K, WADATE Y, ANDOU Y, et al. Electrical-conductivity of molten LaCl3-NaCl, LaCl3-KCL, and LaCl3-CaCl2[J]. Zeitschrift FUR Naturforschung Section A-A Journal of Physical Sciences, 1991, 46(12): 1055-1059.
[18] 高小霞. 电分析化学导论[M]. 北京: 科学出版社, 1986. [19] MONIKA Z M, WLODZIMIERZ S. Electrical conductivity of molten cesium chloride-dysprosium(Ⅲ)[J]. Journal of Molecular Liquids, 2015, 208: 47-51. doi: 10.1016/j.molliq.2015.04.013
[20] REDKIN A, ZAIKOV Y, DEDYUKHIN A, et al. Electrical conductivity of molten electrolytes with a common cation[J]. Journal of the Electrochemical Society, 2011, 158(12): 179. doi: 10.1149/2.028112jes
-
期刊类型引用(5)
1. 付赞辉,阙靓华,廖春发,王旭,周迅. NdF_3在LiF熔盐中的溶解及离子结构. 有色金属科学与工程. 2024(01): 123-129 .  本站查看
本站查看
2. 彭军军,王旭,蔡伯清,石忠宁,任如山. LiF-[CaF_2/YbF_3]-Yb_2O_3熔盐及Yb-Ni合金密度特性研究. 有色金属科学与工程. 2024(02): 189-194 .  本站查看
本站查看
3. 于兵,姚昌昱,张龙飞,贾志鹏,闫奇操. 熔盐电解制备钆铁中间合金电解质体系物化性质. 矿冶. 2024(05): 738-745 .  百度学术
百度学术
4. 张远景,刘兆庭,朱实贵,路贵民. LiCl-KCl-MgCl_2熔盐体系中Li-Mg共沉积机理研究. 有色金属科学与工程. 2023(03): 311-317 .  本站查看
本站查看
5. 张永健,蔡伯清,王旭,王瑞祥,石忠宁. LiF-CaF_2-Yb_2O_3熔盐及Ni-Yb合金表面张力研究. 有色金属科学与工程. 2023(06): 802-807 .  本站查看
本站查看
其他类型引用(1)



 下载:
下载: