Research on thermodynamic model for the removal of carbon dioxide in blast furnace gas by hydrate method
-
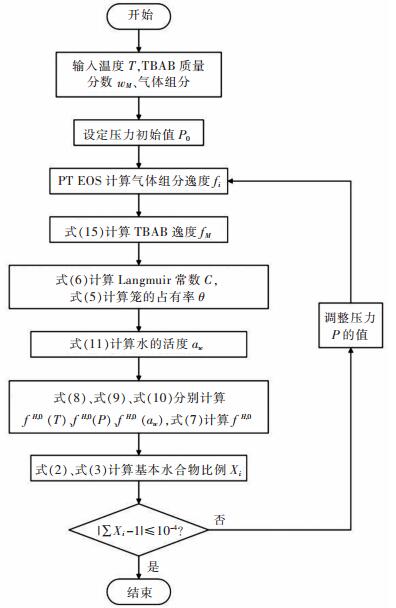
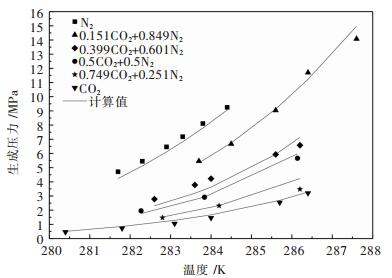
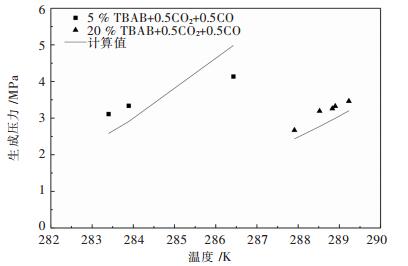
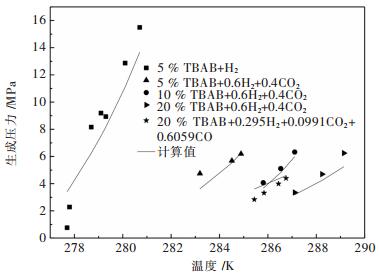
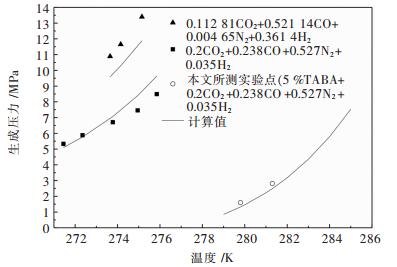
摘要: 提出了将水合物法应用于高炉煤气的脱碳提质.选择正四丁基溴化铵(TBAB)作为热力学促进剂,并基于Chen-Guo水合物热力学模型,对高炉煤气在TBAB溶液中水合物的生成压力进行计算预测.将模型用于含高炉煤气部分组分+TBAB体系的水合物的生成压力计算,计算结果与文献中实验值进行比较,平均相对误差在3 %~16 %左右;而对不同浓度组成的CO2+CO+N2+H2+水体系的水合物生成压力的计算结果比较,平均相对误差在7.5 %~11.7 %左右;用压力探索法测得高炉煤气+TBAB体系水合物的相平衡实验数据,并与计算值进行比较,平均相对误差为16.6 %,表明模型在一定程度上可预测高炉煤气在TBAB溶液中水合物的相平衡条件.Abstract: The application of hydrate method to the removal of carbon dioxide in blast furnace gas was proposed. Tetra-n-butyl ammonium bromide (TBAB) was selected as the thermodynamic promoter. Chen-Guo hydrate thermodynamic model was applied to calculate and predict the pressure of gas hydrate in TBAB solution. The model was used to calculate the pressure of hydrate containing part of blast furnace gas +TBAB, with the average relative error between the calculation result and experimental value in the literature being about 3 %~16 %. The average relative error between calculation results of the hydrate pressure of CO2+CO+N2+H2+water of different concentrations and values in the literature was 7.5 %~11.7 %. Comparing the experimental data of blast furnace gas +TBAB measured by pressure exploration with the calculation results, we found that the average relative error was 16.6 %, which indicated that the model could predict the phase equilibrium condition of blast furnace gas in TBAB solution.
-
Keywords:
- hydrate /
- blast furnace gas /
- carbon dioxide removal /
- TBAB /
- thermodynamic model
-
氯消毒是饮用水安全的重要保障[1-2],但在此过程中由于水中天然有机物的存在,不可避免地会产生多类消毒副产物。截至目前,已确认存在约700种消毒副产物[3],这些副产物均对人类健康造成潜在影响。部分消毒副产物能够显著阻碍哺乳动物的正常生长发育[4],长期饮用含有此类副产物的水,可能增加罹患癌症的风险[5-7]。此外,三卤甲烷等消毒副产物还可能致癌、致畸、致突变[8-10]。
根据《生活饮用水卫生规范(GB 5749—2022)》规定,末梢水需保持自由氯余量至少达到0.05 mg/L。因此,深入研究输配水过程中自由氯的衰减及消毒副产物的产生情况,对于确保饮用水安全具有至关重要的意义。管网材质会显著影响其中的氯衰减情况[11],在4种所选管材中,镀锌钢管对氯衰减的促进作用最强。在铸铁管和钢管中氯的衰减主要归因于输水管材的腐蚀[12]。金属管材中氯胺的衰减速率相较于非金属管材更为显著,加快氯胺的衰减速率有助于减少消毒副产物的生成[13]。
不同管材也会对输配水过程中的消毒副产物产生情况造成影响。球墨铸铁管和聚乙烯管在促进二氧化氯和氯衰减的同时,也可能促使消毒副产物三氯甲烷的生成[14]。不同氯衰减条件对消毒副产物的生成具有不同的影响,特别是金属管材中的氯衰减,往往与零价金属密切相关。对于零价金属在消毒副产物生成中的作用,已有研究[15-16]指出,零价铁会显著增加碘代三卤甲烷的生成量,零价锌的加入会改变各类卤乙酸的生成情况和比例[17]。不同零价金属对体系中的氯衰减和消毒副产物生成情况的作用机制复杂,有待进一步的深入研究。
铜管是饮用水输配送的常用材料,金属铅也因其优良的延展性和可铸造性而广泛应用于各类配件,如垫片、法兰、龙头以及焊接缝等。在铜配件与铅焊料的连接处,往往存在零价铜与零价铅的混合状态[18]。关于零价铜、零价铅及其混合物对消毒剂衰减及消毒副产物生成的影响,尚未有文献报道。以水中常见的消毒副产物三卤甲烷为考查对象,本文旨在探讨零价铜、零价铅及零价铜铅混合物3种体系对氯衰减及消毒副产物生成的具体影响。研究主要从不同pH及不同金属含量2个维度进行,深入分析这些因素对氯衰减的作用机制。同时,通过对零价铜、零价铅及零价铜-铅混合体系中零价金属粉末反应前后的表面形貌及表面元素结合状态的观察,进一步揭示其反应机制。本项研究不仅为饮用水输送管道及配件的选择提供了科学依据,也为后续消毒副产物的深入研究奠定了坚实基础。
1 实验部分
1.1 试剂与仪器
三卤甲烷标准品(三氯甲烷、一溴二氯甲烷、二溴一氯甲烷和三溴甲烷)均购自Sigma-Aldrich公司(上海,中国)。零价铜粉、零价铅粉、浓硫酸、碘化钾、次氯酸钠溶液(有效氯含量为15%)、氢氧化钠等试剂均为分析纯或色谱纯,购自国药集团(北京,中国)。
1.2 氯衰减
氯衰减过程的研究采用批次实验,以500 mL棕色瓶为反应装置,分别加入不同浓度的自由氯、金属粉末等。随后,将样品放入摇床中,在恒定温度25 ℃和转速130 r/min的条件下,于黑暗环境中进行反应。定时对样品进行取样,并检测其中的氯含量。初始有效氯浓度设定为3 mg/L,考查了纯水、零价铜粉、零价铅粉以及零价铜粉-铅粉混合体系在不同pH(6、7、8、9)、碱度(100、150 mg/L的CaCO3)和金属浓度(0、0.5、1 g/L)条件下对氯衰减的影响。所有实验均进行3次平行实验。
1.3 消毒副产物生成
消毒副产物生成实验过程与氯衰减实验类似,将样品置于摇床中,设定温度为25 ℃,转速为130 r/min,并在黑暗条件下反应24 h,以检测三卤甲烷的生成情况。分别考查不同pH(6、7、8)、金属含量(0.2、0.5、1 g/L)、腐殖酸含量(1、5、10 mg/L的TOC)、Br-浓度(1、5、10 μmol/L)等参数对消毒副产物生产的影响。所有实验均进行3次平行实验。
1.4 分析方法
氯含量的测定方法采用国标HJ 586—2010标准方法。三卤甲烷的检测采用气相色谱-电子捕获检测器(7890B,安捷伦科技有限公司,美国),采用美国 EPA标准方法 551。材料表面形貌及元素组成分析分别采用扫描电镜(GeminiSEM360,卡尔·蔡司股份公司,德国)和X射线光电子能谱仪(K-Alpha+,赛默飞世尔科技公司,美国)。
2 结果与讨论
2.1 pH对氯衰减的影响
氯衰减速率随着pH的上升呈现出显著的下降趋势(图1),表明了酸性环境对氯衰减过程的促进作用。在酸性条件下,自由氯主要以氧化性较强的次氯酸形式存在,其能迅速与水中还原性物质如溶解性有机物发生氧化还原反应,进而加速了氯的消耗;在碱性条件下则以氧化性相对较弱的次氯酸根为主[19],以次氯酸根为主导的氧化还原反应进行得不够完全,导致氯的消耗速率减缓。
零价金属粉末的添加均加速了氯衰减的速率。其中,零价金属铜展现了最佳效果,零价铜-铅混合体系次之,而零价金属铅则效果最不明显(如图1(c)所示)。零价金属具有较强的还原性,可被强氧化性的自由氯氧化,从而加速氯的消耗。铅的还原性理论上应强于铜,但其对氯的消耗速率弱于铜。朱润鑫[20]认为零价铅在氧化性氛围内,其表面易形成具有保护作用的氧化膜,阻碍氯对铅的进一步氧化。而在铜-铅混合体系中,零价铅的加入抑制了零价铜对氯的衰减。可能的原因是,在电解质的作用下,零价铜和零价铅形成了微电池效应,从而影响了氯的衰减速率。
2.2 金属含量对氯衰减的影响
在零价铜与零价铅的体系中(如图 2(a)和图 2(b)所示),随着零价金属浓度的逐步提升,氯的衰减速率呈现加速趋势,尤以零价铜体系为显著。可能是由于更多还原性物质的参与,使得氯的反应更为彻底,进而加速了氯的衰减过程。而在零价金属铜-铅的混合体系中(如图 2(c)所示),随着金属浓度的增加,氯的衰减速率呈现先上升后下降的趋势;当混合金属含量为0.5 g/L时,其氯衰减速率相较于混合金属含量1 g/L时更为显著。这一现象可解释为:在铜-铅混合体系中,随着混合金属含量的增加,在电解质的作用下,零价铜与零价铅形成的微电池效应得到加强,这种效应对氯的衰减产生了抑制作用。
2.3 金属表征
2.3.1 电子扫描电镜分析
图3展示了零价铜、铅以及混合体系的电子扫描电镜图像。根据扫描电镜的观察结果,未反应状态下,零价铜颗粒呈现圆润的形态(如图3(a)所示)。而在反应进行24 h后,其表面仅出现了轻微的粗糙化(如图3(b)所示),这表明零价铜在氯消毒过程中受到的影响相对较小。另一方面,未反应状态下零价铅的表面呈现出鳞状结构(如图3(c)所示)。然而,在反应进行24 h后,其表面显著变得粗糙,形成了杂乱无章的条柱体形态(如图3(d)所示),这揭示了零价铅在氯消毒过程中更易受到显著影响。对于零价铜-铅混合体系,在反应24 h后可见大小不一的球状体,其表面伴有条状和点状的物质(如图3(e)所示),这一现象表明在混合体系中,零价金属铜和零价金属铅之间存在相互影响,并发生了一定的团聚现象。
![]() 图 3 金属扫描电镜:(a)、(b)分别为反应前后零价铜扫描照片;(c)、(d)分别为反应前后零价铅扫描照片;(e)零价铜-铅体系反应后扫描照片Figure 3. Scanning electron microscopy images for target metal samples: (a, b) images of zero-valent Cu before and after the reaction; (c, d) images of zero-valent Pb before and after the reaction; (e) image of Cu-Pb mixtures after the reaction
图 3 金属扫描电镜:(a)、(b)分别为反应前后零价铜扫描照片;(c)、(d)分别为反应前后零价铅扫描照片;(e)零价铜-铅体系反应后扫描照片Figure 3. Scanning electron microscopy images for target metal samples: (a, b) images of zero-valent Cu before and after the reaction; (c, d) images of zero-valent Pb before and after the reaction; (e) image of Cu-Pb mixtures after the reaction2.3.2 X 射线光电子能谱分析
图4展示了零价铜、铅以及混合体系的X射线光电子能谱结果。与反应前图4(a)相比,图4(b)和图4(c)的X射线光电子能谱图中均出现了代表Cu(Ⅱ)的卫星峰,这一变化明确指示了反应后二价铜氧化物的生成。图4(d)、图4(e)为反应24 h前后铅元素X射线光电子能谱图,图4(f)为铜-铅体系中铅元素的X射线光电子能谱图,反应前后铅元素的的轨道电子发生了显著变化,铅元素由零价变为+2、+3混合价态。
![]() 图 4 X射线光电子能谱: (a)、(b)为反应24 h前后零价铜体系的铜元素;(c)为反应24 h后的铜-铅体系的铜元素;(d)、(e)为反应24 h前后零价铅体系的铅元素;(f)为反应24 h后的铜-铅体系的铅元素Figure 4. X-ray photoelectron spectroscopy spectra of target metal samples: (a, b) Cu in the zero-valent Cu system before and after reacted for 24 h; (c) Cu in the Cu-Pb mixture system after reacted for 24 h; (d, e) Pb in the zero-valent Pb system before and after reacted for 24 h; (f) Pb in the Cu-Pb mixture system after reacted for 24 h
图 4 X射线光电子能谱: (a)、(b)为反应24 h前后零价铜体系的铜元素;(c)为反应24 h后的铜-铅体系的铜元素;(d)、(e)为反应24 h前后零价铅体系的铅元素;(f)为反应24 h后的铜-铅体系的铅元素Figure 4. X-ray photoelectron spectroscopy spectra of target metal samples: (a, b) Cu in the zero-valent Cu system before and after reacted for 24 h; (c) Cu in the Cu-Pb mixture system after reacted for 24 h; (d, e) Pb in the zero-valent Pb system before and after reacted for 24 h; (f) Pb in the Cu-Pb mixture system after reacted for 24 h2.4 pH对三卤甲烷形成的影响
图5展示了不同pH对氯代和溴代三卤甲烷形成的影响。在选定pH(6~8)范围内,溶液pH对三卤甲烷生成总量的影响较小。在零价铜及零价铜-铅混合体系中,pH的升高略微提高氯代和溴代三卤甲烷的总产量,这与本文2.1节中氯衰减情况的结果相吻合。pH的增加,导致氯的衰减速率减缓,更多的余氯与腐殖酸重复反应,从而生成更多的氯代和溴代三卤甲烷。水溶液中自由氯的形态受pH控制,当pH<7.5时,自由氯以HClO形态为主,HClO的氧化能力更强,更易与零价金属发生反应,导致自由氯含量减少,进而降低氯代和溴代三卤甲烷的生成[21-23]。
![]() 图 5 不同pH对氯代和溴代三卤甲烷形成的影响(反应条件:有效氯初始浓度为15 mg/L、Br-离子浓度5 μmol/L、腐殖酸浓度5mg TOC/L、金属含量1 g/L)Figure 5. Effect of different pH values on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, Br-ion concentration 5 μmol/L, humic acid concentration 5mg TOC/L and metal content 1 g/L)
图 5 不同pH对氯代和溴代三卤甲烷形成的影响(反应条件:有效氯初始浓度为15 mg/L、Br-离子浓度5 μmol/L、腐殖酸浓度5mg TOC/L、金属含量1 g/L)Figure 5. Effect of different pH values on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, Br-ion concentration 5 μmol/L, humic acid concentration 5mg TOC/L and metal content 1 g/L)在本研究中溴离子是三卤甲烷中溴元素的唯一来源,控制组和零价铅体系中自由氯的相对含量较高(如2.2节部分实验结果所示),溴离子浓度的增加有利于三卤甲烷的生成。而在无金属体系中,氯代和溴代三卤甲烷总量的波动可能并非主要受到pH的影响[24],这与之前的研究结果相一致,即在水中有机物和溴离子浓度较高时,三卤甲烷类消毒副产物的形成更具随机性[25]。在检测的4种氯代和溴代三卤甲烷消毒副产物中,三氯甲烷和一溴二氯甲烷占据主导地位,而二溴一氯甲烷和三溴甲烷的生成量相对较少,约占总量的5%。
2.5 金属含量对三卤甲烷形成的影响
在溴离子存在的条件下,不同金属含量对氯代和溴代三卤甲烷的生成影响如图6所示。不同金属含量体系下均有4种氯代和溴代三卤甲烷生成,且三氯甲烷的生成趋势与总的氯代和溴代三卤甲烷的生成趋势呈现出相似的规律。在零价铜体系中,随着零价铜含量的递增,氯代和溴代三卤甲烷的浓度呈现出逐渐降低的趋势。当体系中添加1 g/L零价铜时,目标三卤甲烷生成总量降低33%。这一变化可能归因于次氯酸/次氯酸根的消耗随零价铜含量的增加而加剧,导致较少的活性物质参与反应,进而减少氯代和溴代三卤甲烷的生成量。
![]() 图 6 不同含量的金属对氯代和溴代三卤甲烷形成的影响(反应条件:有效氯初始浓度为15 mg/L、Br-离子浓度5 μmol/L、腐殖酸浓度5mg TOC/L、pH为7)Figure 6. Effects of different metal contents on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, Br-ion concentration 5 μmol/L, humic acid concentration 5mg TOC/L and pH was 7)
图 6 不同含量的金属对氯代和溴代三卤甲烷形成的影响(反应条件:有效氯初始浓度为15 mg/L、Br-离子浓度5 μmol/L、腐殖酸浓度5mg TOC/L、pH为7)Figure 6. Effects of different metal contents on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, Br-ion concentration 5 μmol/L, humic acid concentration 5mg TOC/L and pH was 7)在零价铅体系中,氯代和溴代三卤甲烷的总量呈现先上升后下降的趋势。在零价铅含量较少时,自由氯含量下降不明显,余氯能迅速氧化溴离子生成次溴酸,进而促进三卤甲烷的生成。当零价铅的含量增加到1 g/L时,零价铅和溴离子、有机物共同竞争自由氯,导致三卤甲烷的生成受到抑制。
在零价铜-铅混合体系中,当金属含量较低时(0~0.2 g/L),三卤甲烷的生成量随混合金属含量的增加而上升。随着混合金属含量的进一步增加,氯代和溴代三卤甲烷的生成量出现下降趋势,并在混合金属含量>0.5 g/L逐渐达到平衡。这一现象可能源于在混合体系中,当金属含量较低时,零价金属铅主导了整个体系的三卤甲烷生成量,其作用形式与零价铅体系相似。随着混合体系金属浓度的增加,零价金属铜逐渐占据主导地位,而零价金属铅则发挥一定的促进作用。然而,当混合体系金属浓度进一步升高时,氯代和溴代三卤甲烷的生成量趋于稳定,可能表明整个体系已达到一种相对稳定的状态。
2.6 腐殖酸浓度对三卤甲烷形成的影响
如图7所示,不同腐殖酸浓度对三卤甲烷的生成具有显著影响。随着腐殖酸浓度的增加,不同系统中三卤甲烷的生成总量均呈现出增长的趋势。这一趋势与先前的研究成果相吻合,即腐殖酸的存在对三卤甲烷的生成具有积极的促进作用[26-27]。腐殖酸是三卤甲烷生成的重要前驱物,在较低浓度时,前驱物含量的增加,更有利于氯代和溴代三卤甲烷的产生。当腐殖酸浓度超过1 mg/L时,三卤甲烷的产量将逐渐趋于稳定,达到一种平衡状态。这一现象表明,在腐殖酸含量充足时,自由氯含量是三卤甲烷的生成的控制因素。
![]() 图 7 不同腐殖酸浓度对三卤甲烷生成量的影响(反应条件:有效氯初始浓度为15 mg/L、Br-离子浓度5 μmol/L、金属含量1 g/L、pH为7)Figure 7. Effect of different humic acid concentrations on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, Br- concentration 5 μmol/L, metal content 1 g/L and pH was 7)
图 7 不同腐殖酸浓度对三卤甲烷生成量的影响(反应条件:有效氯初始浓度为15 mg/L、Br-离子浓度5 μmol/L、金属含量1 g/L、pH为7)Figure 7. Effect of different humic acid concentrations on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, Br- concentration 5 μmol/L, metal content 1 g/L and pH was 7)在零价铜和铜-铅混合体系中,三卤甲烷的产生量低于控制组和零价铅体系。一方面,腐殖酸中的羟基、羧基等官能团可与零价铜表面的活性位点结合,导致腐殖酸与自由氯的反应活性受到影响[28],从而抑制体系中氯代和溴代三卤甲烷的生成;另一方面,由本文2.1节及2.2节可知,控制组和零价铅体系下氯的衰减速率较小,更多的余氯会与水中溶解性有机物发生反应,从而生成更多的氯代和溴代三卤甲烷。
2.7 溴离子浓度对三卤甲烷生成的影响
溴离子是三卤甲烷中溴元素的主要来源。如图8所示,通过对4种体系中溴离子浓度的调整,发现氯代和溴代三卤甲烷的总量随溴离子浓度的上升而逐渐降低。这主要是因为消毒剂不仅能将溴离子转化为次溴酸和次溴酸根,还能进一步形成BrCl、Br2、Br2O、BrOCl等化合物[1, 29-30]。而值得注意的是,自由氯和自由溴是三卤甲烷形成的主要前体活性物质。溴离子浓度过高,会导致BrCl、Br2、Br2O、BrOCl等化合物的生成,导致自由氯的消耗和自由溴生成的减少,三卤甲烷的生成浓度呈现下降趋势。
![]() 图 8 溴离子浓度对三卤甲烷生成情况的影响(反应条件:有效氯初始浓度为15 mg/L、腐殖酸浓度5 mg/L的TOC、金属含量1 g/L、pH为7)Figure 8. Effect of bromine ion concentration on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, TOC with humic acid concentration 5 mg/L, metal content 1 g/L and pH was 7)
图 8 溴离子浓度对三卤甲烷生成情况的影响(反应条件:有效氯初始浓度为15 mg/L、腐殖酸浓度5 mg/L的TOC、金属含量1 g/L、pH为7)Figure 8. Effect of bromine ion concentration on the formation of chlorinated and brominated trihalomethanes(Reaction conditions: the initial concentration of effective chlorine was 15 mg/L, TOC with humic acid concentration 5 mg/L, metal content 1 g/L and pH was 7)零价铅体系显示出了最高的氯代和溴代三卤甲烷生成量,这与图2所呈现的结果相吻合。此现象归因于零价铅体系中氯的衰减速率较慢,导致体系中余氯含量较高,从而与腐殖酸反应生成更多的氯代及溴代三卤甲烷。零价铜-铅混合体系中的三卤甲烷生成量较小,可能是潜在原电池效应,导致自由氯的衰减速率增加,体系中与有机物发生反应的余氯浓度较低,三卤甲烷的生成受到了抑制。
3 结论与展望
在饮用水输送过程中,管材及配件的材质特性会对管网余氯及消毒副产物情况造成影响,本研究深入探讨了零价铜、铅及混合体系对氯衰减及消毒副产物生成的影响。研究结果显示,这3种体系均能有效促进氯衰减,其中零价金属铜体系在促进氯衰减方面表现最为显著,而零价金属铅体系则效果相对较弱。在单金属体系中,氯衰减速率随pH的降低和金属含量的增加而呈现出增加的趋势;而在混合金属体系中,氯衰减速率则随着金属含量的增加先加快后减慢。在氯化过程中,零价金属铜逐渐转变为氧化铜,而铅元素由零价变为+2、+3混合价态。氯代及溴代三卤甲烷的生成量在pH为6~8的范围内变化并不显著,整体上随着金属含量的增加而呈现降低的趋势。然而,在零价金属铅和混合金属体系中,这一趋势呈现出波动现象。此外,随着腐殖酸浓度的增加,氯代及溴代三卤甲烷的生成量也随之增加;而随着溴离子浓度的增加,其生成量则呈现降低的趋势。
-
表 1 计算气体Langmuir常数的Antoine参数
Table 1 The Antoine parameter for calculating the Langmuir constant of gas

表 2 β、λ1、λ2、α的取值
Table 2 The value of β、λ1、λ2、α

表 3 二元相互作用参数Aij
Table 3 The binary cross interaction parameter Aij

表 4 计算不同气体的fiH, 0(T)的Antoine参数
Table 4 The Antoine parameter for calculating fiH, 0(T) of different gases

表 5 计算TBAB的fiH, 0(T)的Antoine参数
Table 5 The Antoine parameter for calculating fiH, 0(T) of TBAB

表 6 vj∞及Hj(1)、Hj(2)、Hj(3)、Hj(4)的取值
Table 6 The value of vj∞ and Hj(1)、Hj(2)、Hj(3)、Hj(4)

-
[1] 王筱留.钢铁冶金学, 炼铁部分[M].北京:冶金工业出版社, 2013. [2] 苍大强.国内外冶金工业源头节能减排的新方法、新技术[J].有色金属科学与工程, 2015, 6(6):1-6. http://ysjskx.paperopen.com/oa/darticle.aspx?type=view&id=201506001 [3] 李长乐, 薛庆国, 董择上, 等.氧气高炉喷吹气化炉重整煤气工艺的火用分析[J].有色金属科学与工程, 2018, 8(2):6-12. http://ysjskx.paperopen.com/oa/DArticle.aspx?type=view&id=201802002 [4] 杜开平, 赵世强, 吴胜利.熔融气化炉风口回旋区冶炼特征的数值模拟研究[J].有色金属科学与工程, 2017, 8(2):8-13. http://ysjskx.paperopen.com/oa/darticle.aspx?type=view&id=2017020002 [5] 蓝荣宗, 王静松, 韩毅华, 等.高还原势气氛下烧结矿低温还原粉化试验研究[J].有色金属科学与工程, 2012, 3(1):5-9. http://ysjskx.paperopen.com/oa/darticle.aspx?type=view&id=201201002 [6] SLOAN E D. Fundamental principles and applications of natural gas hydrates[J]. Nature, 2003, 426(6964):353. doi: 10.1038/nature02135
[7] 李小森, 鲁涛, 陈朝阳, 等.水合物法分离烟气(CO2/N2)中CO2的实验研究[J].现代化工, 2009, 29(10):37-40. doi: 10.3321/j.issn:0253-4320.2009.10.009 [8] CHEN G J, GUO T M. A new approach to gas hydrate modelling[J]. Chemical Engineering Journal, 1998, 71(2):145-151. doi: 10.1016/S1385-8947(98)00126-0
[9] CHEN G J, GUO T M. Thermodynamic modeling of hydrate formation based on new concepts[J]. Fluid Phase Equilibria, 1996, 122(1/2):43-65. doi: 10.1016-0378-3812(96)03032-4/
[10] 赵光华. CO2-N2-TBAB-H2O体系水合物生成实验和模型研究[J].石油化工高等学校学报, 2016, 29(6):11-17. doi: 10.3969/j.issn.1006-396X.2016.06.003 [11] HASHIMOTO S, SUGAHARA T, MORITOKI M, et al. Thermodynamic stability of hydrogen + tetra- n -butyl ammonium bromide mixed gas hydrate in nonstoichiometric aqueous solutions[J]. Chemical Engineering Science, 2008, 63(4):1092-1097. doi: 10.1016/j.ces.2007.11.001
[12] LIAO Z, GUO X, ZHAO Y, et al. Experimental and modeling study on phase equilibria of semiclathrate hydrates of tetra-n-butyl ammonium bromide + CH4, CO2, N2, or Gas Mixtures[J]. Industrial & Engineering Chemistry Research, 2013, 52(51):18440-18446. http://d.old.wanfangdata.com.cn/Periodical/hgxb201311014
[13] SUN Q, GUO X, LIU A, et al. Formation conditions and thermodynamic model predictions of carbon monoxide hydrates[J]. Fluid Phase Equilibria, 2011, 307(1):95-99. doi: 10.1016/j.fluid.2011.04.016
[14] WANG Y, ZHANG J, GUO X, et al. Experiments and modeling for recovery of hydrogen and ethylene from fluid catalytic cracking (FCC) dry gas utilizing hydrate formation[J]. Fuel, 2017, 209:473-489. doi: 10.1016/j.fuel.2017.07.108
[15] MOHAMMADI A H, ESLAMIMANESH A, BELANDRIA V, et al. Phase equilibria of semiclathrate hydrates of CO2, N2, CH4, or H2 + tetra-n-butylammonium bromide aqueous solution[J]. Journal of Chemical & Engineering Data, 2011, 56(10):3855-3865. doi: 10.1021/je2005159
[16] KIM S M, JU D L, LEE H J, et al. Gas hydrate formation method to capture the carbon dioxide for pre-combustion process in IGCC plant[J]. International Journal of Hydrogen Energy, 2011, 36(1):1115-1121. doi: 10.1016/j.ijhydene.2010.09.062
[17] WANG S, DANNER M, KUCHLING T, et al. Measurement of the three-phase (vapour+liquid+solid) equilibrium conditions of semi-clathrates formed from mixtures of CO2, CO and H2[J]. Journal of Chemical Thermodynamics, 2013, 56(3):149-152. http://www.sciencedirect.com/science/article/pii/S0021961412002923
[18] BELVÉZE L S, BRENNECKE J F, STADTHERR M A. Modeling of activity coefficients of aqueous solutions of quaternary ammonium salts with the electrolyte-NRTL equation[J]. Industrial & Engineering Chemistry Research, 2004, 43(3): 815-825. http://cn.bing.com/academic/profile?id=4fa83067dc80c4f6153316b409423a80&encoded=0&v=paper_preview&mkt=zh-cn
[19] CHEN C C, EVANS L. A local composition model for excess Gibbs energy of electrolyte systems[J]. Aiche Journal, 1986, 32(3):444-454. doi: 10.1002/(ISSN)1547-5905
[20] KLAUDA J B, SANDLER S I.Phase behavior of clathrate hydrates: a model for single and multiple gas component hydrates[J]. Chemical Engineering Science, 2003, 58(1):27-41. http://www.sciencedirect.com/science/article/pii/S0009250902004359
[21] MOORE J C, BATTINO R, RETTICH T R, et al. Partial molar volumbes of gases at infinite dilution in water at 298.15 K[J]. Journal of Chemical & Engineering Data, 1982, 27(1):22-24. http://cn.bing.com/academic/profile?id=6db7b1852b65403a9d5ae899c42293e6&encoded=0&v=paper_preview&mkt=zh-cn
[22] RETTICH T R, BATTINO R, WILHELM E. Solubility of gases in liquids. 15. high-Precision determination of henry coefficients for carbon monoxide in liquid water at 278 to 323K[J]. Berichte der Bunsenge sells chaftfür physicali sche Chemie, 1982, 86(12): 1128-1132. http://cn.bing.com/academic/profile?id=80d48a8b0a367ed24ea10e245ad4cfbe&encoded=0&v=paper_preview&mkt=zh-cn
[23] PATEL N C, TEJA A S. A new cubic equation of state for fluids and fluid mixtures[J]. Chemical Engineering Science, 1982, 37(3):463-473. doi: 10.1016/0009-2509(82)80099-7
[24] LIAO Z X, GUO X Q, LI Q, et al. Experimental and modeling study on the phase equilibria for hydrates of gas mixtures in TBAB solution[J]. Chemical Engineering Science, 2015, 137:656-664. doi: 10.1016/j.ces.2015.07.019
[25] DUC N H, CHAUVY F, HERRI J M. CO2 capture by hydrate crystallization-A potential solution for gas emission of steelmaking industry[J]. Energy Conversion & Management, 2007, 48(4):1313-1322. http://www.sciencedirect.com/science/article/pii/S0196890406003025
[26] MOHAMMADI A H, ESLAMIMANESH A, BELANDRIA V, et al. Phase equilibrium measurements for semi-clathrate hydrates of the (CO2+N2+tetra-n-butylammonium bromide) aqueous solution system[J]. Journal of Chemical Thermodynamics, 2012, 46(5):57-61. http://d.scholar.cnki.net/detail/SJES_U/SJES13011601307174
[27] MEYSEL P, OELLRICH L, BISHNOI P R, et al. Experimental investigation of incipient equilibrium conditions for the formation of semi-clathrate hydrates from quaternary mixtures of (CO2+N2+TBAB+H2O)[J]. Journal of Chemical Thermodynamics, 2011, 43(10):1475-1479. doi: 10.1016/j.jct.2011.04.021
[28] 孙强, 刘爱贤, 郭绪强.水合物法分离合成气实验研究[J].高校化学工程学报, 2010, 24(5):739-744. doi: 10.3969/j.issn.1003-9015.2010.05.003 [29] KWAK G H, SA J H, KIM S H, et al. Effects of promoter on the formation of gas hydrate from blast furnace gas[J]. Korean Chemical Engineering Research, 2015, 53(1):103-110. doi: 10.9713/kcer.2015.53.1.103
[30] LI D L, DU J W, FAN S S, et al. Clathrate dissociation conditions for methane+tetra-n-butyl ammonium bromide (TBAB)+Water[J]. Journal of Chemical & Engineering Data, 2007, 52(5):1916-1918. http://cn.bing.com/academic/profile?id=1ecd3c182c39019de14d525cb091171c&encoded=0&v=paper_preview&mkt=zh-cn




 下载:
下载: