The extraction and separation of rubidium from high potassium and sodium contained brine using t-BAMBP
-
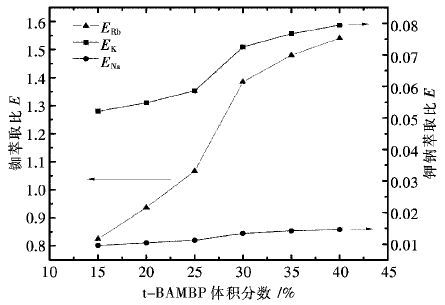
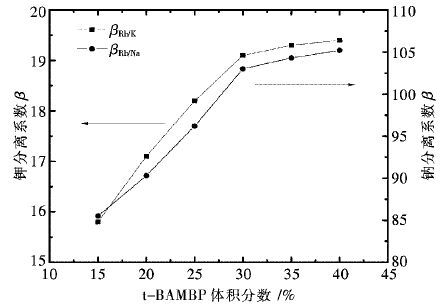
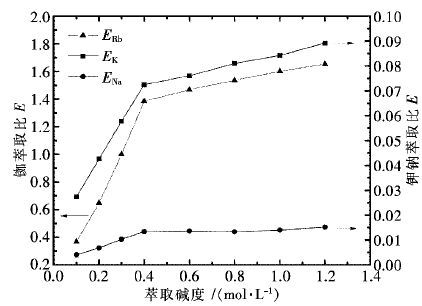
摘要: 以二甲苯为稀释剂的t-BAMBP萃取体系,从高钾钠卤水中萃取分离铷.研究了有机相配比、料液碱度、相比、萃取时间及萃取温度对萃取分离铷效果的影响.研究结果表明:在有机相组成(体积分数)为30% t-BAMBP+70% 二甲苯,料液Rb+初始浓度为0.011 7 mol/L,料液碱度为0.4 mol/L,相比VO/VA(有机相体积比水相体积)为1/1,萃取时间为4 min,萃取温度为21 ℃的条件下,经过五级逆流萃取,铷萃取率达95.5%.通过对料液进行多段萃取处理,可获得高纯度的铷盐.Abstract: T-BAMBP extraction system with xylene as diluent was taken to separate rubidium from brine contained high potassium and sodium. The influences of organic phase composition, feed liquid alkalinity,organic-aqueous phase ratio, extraction time and temperature on extraction and separation efficiency were researched. The results showed that extraction rate of rubidium after five stage countercurrent extraction can reach 95.5% using 30% volume fraction t-BAMBP contained organic extractant with 0.4mol/L feed liquid alkalinity,0.0117mol/L initial concentration of Rb+,1:1 phase ratio, 4 minutes extraction time and 21℃ extraction temperature. Highly purified rubidium salt can be obtained through multistage extraction.
-
Keywords:
- rubidium /
- extraction /
- separation efficiency /
- extraction rate
-
国内某企业以金属钴和钴基电池材料为主要发展方向,目前已形成每年4 000 t电积钴、1.2万t Co3O4和5.2万t三元前驱体的生产能力,钴金属量年综合产能超过1.2万t。由于国内钴资源稀缺[1-2],该企业主要通过进口非洲水钴矿、Co(OH)2,CoCO3等弥补缺口。其中Co3O4等钴产品的湿法生产中会生成含大量锰、铜、锌及钴金属资源的铜锰渣,若将其返回火法系统回收铜、钴等,钴的损失率高且锰、铜等进入炉渣造成浪费[3-5]。
当前,国内矿产资源匮乏,有色金属冶金领域面临严重的环境、能源、资源、经济等问题[6-8],及其必要找到合适的湿法流程回收这些铜锰渣中的金属资源,而首先实现铜离子高效分离是流程的关键。在湿法工艺上回收铜方面,相对于置换法[9-10]、离子交换法[11-12]、溶剂萃取法[13-15]等,化学沉淀法[16-18]具有低成本、处理量大、工艺简单等优点,其中又以硫化沉淀法为主。常用的硫化剂有H2S、Na2S、NaHS等[19-23],使用H2S做硫化剂,沉铜效率高但对设备要求严格,也容易造成环境污染与身体伤害;Na2S是最常见的硫化剂,但酸性体系中容易生成H2S气体,且不易控制S2-离子浓度。针对以上问题,本文提出先用H2SO4浸出铜锰渣中金属元素,再用Na2S2O3选择性沉淀分离浸出液中的铜,分别探究了2个工艺不同条件下的实验效果。
1 实验
1.1 实验原料
实验采用国内某企业提供的铜锰渣,含水率为23.6%,表面呈灰褐色。首先将铜锰渣干燥-破碎-球磨-筛分预处理,形成直径约为0.074 mm(80%~90%)的均匀颗粒备用。表 1所列为铜锰渣元素成分分析结果,由表 1可知铜锰渣中主要的金属元素为锰、铜、锌、钴,且锰的含量最多,铜次之;铜锰渣XRD分析结果如图 1所示,由图 1可知铜锰渣中存在的物相主要为Mn3O4,CuMn2O4及ZnMn2O4。
表 1 铜锰渣元素成分分析结果Table 1. Analysis results of element composition of copper manganese slag
1.2 实验方法
铜锰渣酸浸过程:将一定浓度H2SO4溶液与适量的铜锰渣混合于单孔烧瓶内充分反应,反应过程使用恒温水浴锅加热,搅拌器搅拌。
酸浸液硫化沉铜过程:先量取100 mL酸浸液置于250 mL三孔烧瓶内,固定烧瓶在水浴锅上,再称量Na2S2O3(理论摩尔数等于100 mL酸浸液中铜离子的摩尔数)充分溶解至20 mL左右,待水浴锅升至预定温度,启动搅拌器,缓慢滴加Na2S2O3溶液,同时开始计时。反应结束,滤液抽滤量取体积,沉铜渣干燥并称取质量。实验过程使用电感耦合等离子发射光谱仪(ICAP7400 Radial)分析液相及渣相金属离子含量,用X射线衍射仪(TTR Ⅲ)分析铜锰渣及生成渣的物相。
1.3 实验原理
铜锰渣酸浸可能发生的主要反应如下:

(1) 
(2) 
(3) 室温下3个反应的Gibbs自由能分别为:-46.167,-42.971,-38.239 kJ/mol,说明上述反应在热力学上都能自发进行。从反应方程式可知,铜锰渣酸浸过程可生成MnO2,从而降低锰的浸出率。
选择性硫化沉淀是基于不同金属离子与S2-离子亲和力的差异,溶度积小的金属离子优先沉淀。铜锰渣酸浸液中主要有Mn2+,Cu2+,Zn2+,Co2+离子,25 ℃下4种金属硫化物溶度积如表 2所列。由表 2可知,CuS的溶度积远远小于ZnS,CoS,MnS,可优先形成沉淀。
沉铜过程可能发生的主要反应如下:

(4) 
(5) 
(6) 从反应方程式可知,Na2S2O3与H2O反应可有效提供S2-离子,并与溶液中的Co2+,Zn2+,Mn2+离子反应生成共沉淀,但只要溶液中还含有Cu2+离子,就会与生成的CoS,ZnS,MnS发生置换,具体反应如下:

(7) 
(8) 
(9) 2 实验结果与讨论
2.1 铜锰渣酸浸实验
2.1.1 H2SO4用量对浸出率的影响
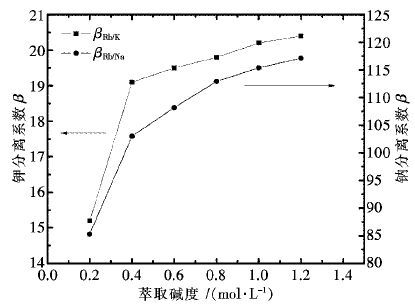
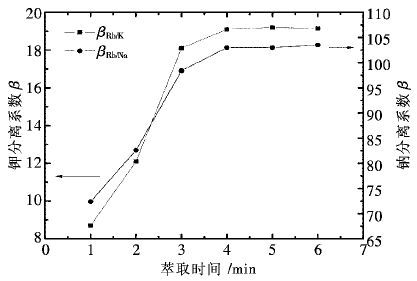
控制反应温度为80 ℃,液固体积质量比为5∶1,反应时间为3 h,搅拌器转速为300 r/min,常压下不同H2SO4用量对各金属的浸出效果如图 2所示。
由图 2可知,当H2SO4用量小于150 g/L,铜、钴、锌的浸出率随H2SO4用量增加而大幅度上升,继续增加H2SO4用量,铜、钴、锌的浸出率上升趋势变缓,并于200 g/L时达到最大值。锰的浸出率随H2SO4用量增加而缓慢增加,并于200 g/L时基本保持不变,说明此时铜锰渣的酸浸反应已基本完成。对比铜锰渣中各金属浸出率,铜、钴、锌的浸出率高,锰的浸出率低,这是因为铜锰渣与酸反应生成了MnO2。因此,选择较优的H2SO4用量为200 g/L,该条件下铜、钴、锌、锰的浸出率分别为98.14%,98.05%,98.55%,24.51%。
2.1.2 液固体积质量比对浸出率的影响
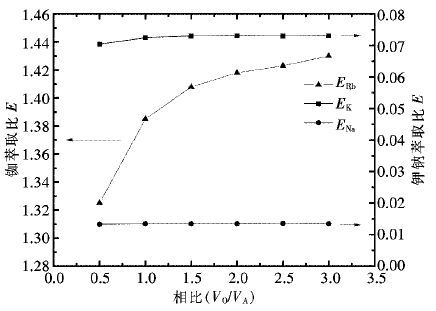
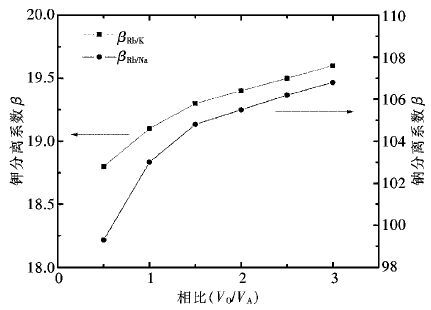
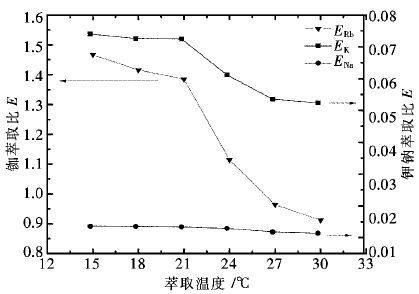
控制H2SO4用量为200 g/L,反应温度为80 ℃,反应时间为3 h,其他条件不变,常压下不同液固体积质量比对各金属的浸出效果如图 3所示。
由图 3可知,当液固比从4∶1增加到6∶1,铜、钴、锌的浸出率上升趋势明显;当液固比从6∶1增加到8∶1,液固比对钴的浸出率几乎无影响,铜、锌的浸出率小范围增加,并基本于液固比为7∶1时达到最大值。锰的浸出率随液固比增加缓慢增加,但是上升的趋势较为平缓。酸浸过程液固比小会增加溶液黏度,影响铜锰渣的浸出效率,反之则导致浸出液体积增加,金属离子浓度下降,耗酸量也同步上升。因此,选择较优的液固体积质量比为7∶1,该条件下铜、钴、锌、锰的浸出率分别为99.35%,99.21%,99.77%,25.13%。
2.1.3 反应温度对浸出率的影响
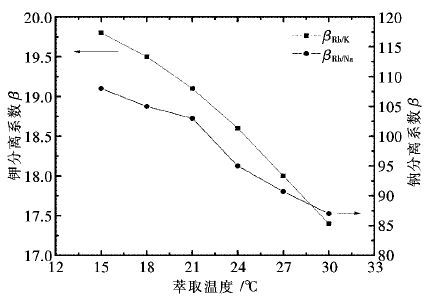
控制H2SO4用量为200 g/L,液固体积质量比为7∶1,反应时间为3 h,其他条件不变,常压下不同反应温度对各金属的浸出效果如图 4所示。
由图 4可知,当温度从50 ℃升高到80 ℃,铜、锌的浸出率缓慢增加,继续升高温度,铜、锌的浸出率基本保持不变;当温度从50 ℃升高到90 ℃,钴的浸出率先增加后保持不变。同时温度小于80 ℃,锰的浸出率缓慢增加,继续升高温度对锰的浸出率基本无影响。因此,选择较优的反应温度为80 ℃,该条件下铜、钴、锌、锰的浸出率分别为99.35%,99.21%,99.77%,25.13%。
2.1.4 反应时间对浸出率的影响
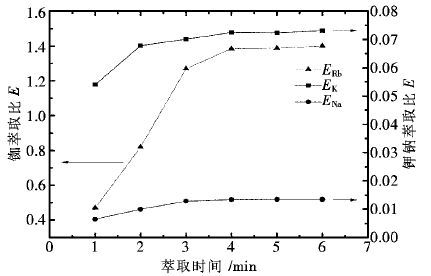
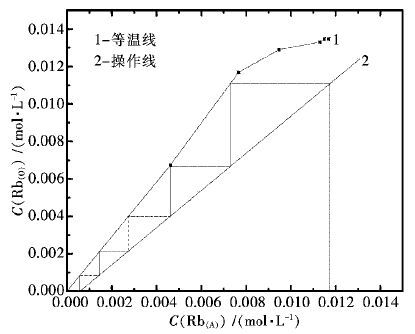
控制H2SO4用量为200 g/L,液固体积质量比为7∶1,反应温度为80 ℃,其他条件不变,常压下不同反应时间对各金属的浸出效果如图 5所示。
由图 5可知,反应时间为1 h,铜、钴、锌已有较高的浸出率,说明含锰物料的酸浸反应所需时间较短。当反应时间从1 h增加到2 h,铜、锌的浸出率基本保持不变,钴的浸出率有所上升,这可能是因为随着物料不断溶出,原先被包裹的钴不断与酸接触反应;当反应时间从2 h增加到5 h,铜、钴、锌的浸出率基本保持不变。同时随着反应时间增加,锰的浸出率变化较小。因此,选择较优的反应时间为2 h,该条件下铜、钴、锌、锰的浸出率分别为99.81%,99.54%,99.07%,24.10%。
2.1.5 较优条件实验
根据以上铜锰渣浸出单因素条件实验,固定H2SO4用量为200 g/L,液固体积质量比为7∶1,反应温度为80 ℃,反应时间为2 h,做3组平行实验。结果如表 3所列,图 6所示为浸出渣XRD图谱。
表 3 较优条件实验结果Table 3. Experimental results of optimal conditions
由表 3可知,铜锰渣在较优酸浸条件下,铜、钴、锌、锰的平均浸出率分别为99.80%,99.53%,99.06%,24.07%,铜锰渣中铜、钴、锌已几乎全部浸出;由图 6可知,浸出渣主要成分为MnO2。
2.2 酸浸液选择性沉铜实验
2.2.1 Na2S2O3用量倍数对沉铜效果的影响
控制反应温度为70 ℃,反应时间为2 h,搅拌器转速为300 r/min,不同Na2S2O3用量倍数对沉铜效果的影响如图 7所示。
由图 7可知,随着Na2S2O3用量倍数增加到2.0,铜的沉淀率迅速升高,钴、锌、锰的沉淀率缓慢增加且比较接近,这是因为随着Na2S2O3用量增加,溶液中的H2S浓度不断上升,间接提高了溶液中S2-离子浓度。当Na2S2O3用量倍数大于2.0,铜的沉淀率保持不变,钴、锌、锰的沉淀率增加趋势明显,说明此时Na2S2O3已过量。因此,选择较优的Na2S2O3用量倍数为2.0,该条件下铜的沉淀率为99.99%,钴、锌、锰的沉淀率分别为0.30%,0.38%,0.35%。
2.2.2 反应时间对沉铜效果的影响
控制Na2S2O3用量倍数为2.0,温度为70 ℃,搅拌器转速为300 r/min,其他条件不变,考察反应时间对沉铜效果的影响,结果如图 8所示。
由图 8可知,随着反应时间增加,铜的沉淀率变化不明显,当反应时间从45 min增加到90 min,铜的沉淀率从99.05%增加到99.99%,已达到最大值,说明溶液中Cu2+离子的硫化沉铜反应比较容易进行,且用时较短。当反应时间从45 min增加到105 min,钴,锌,锰的沉淀率变化趋势较小,基本处于稳定状态。为充分将铜沉淀完全,使得沉铜后液中Cu2+离子浓度满足后续工艺有价金属分离提纯要求(小于5 mg/L),选择较优的反应时间为90 min,该条件下铜的沉淀率为99.99%,钴、锌、锰的沉淀率分别为0.26%,0.34%,0.29%。
2.2.3 反应温度对沉铜效果的影响
控制Na2S2O3用量倍数为2.0,反应时间为90 min,搅拌器转速为300 r/min,其他条件不变,考察反应温度对沉铜效果的影响,结果如图 9所示。
由图 9可知,随着温度升高,铜的沉淀率缓慢增加,70 ℃时铜的沉淀率已达到最大值,继续升高温度,铜的沉淀率保持不变,同时钴、锌、锰的沉淀率变化波动较小。因此,选择较优的反应温度为70 ℃,该条件下铜的沉淀率为99.99%,钴、锌、锰的沉淀率分别为0.26%,0.34%,0.29%。
2.2.4 较优条件实验
根据以上铜锰渣酸浸液选择性沉铜单因素实验,确定较优实验条件:Na2S2O3用量倍数为2.0,时间为90 min,温度为70 ℃。该条件下,分别做3组平行实验,结果如表 4所列,表 5所列为2号沉铜渣元素成分分析结果,图 10所示为沉铜渣XRD分析结果。
表 4 较优条件实验结果Table 4. Experimental results of optimal conditions 表 5 2号沉铜渣元素成分分析结果Table 5. Analysis results of element composition of No.2 copper slag
表 5 2号沉铜渣元素成分分析结果Table 5. Analysis results of element composition of No.2 copper slag
由表 4可知,较优条件下铜锰渣酸浸液中铜离子的沉淀率稳定在99.99%,钴、锌、锰的平均沉淀率分别为0.24%,0.33%,0.27%;由表 5可知,沉铜渣中铜的含量高达58.05%,钴、锌、锰的杂质含量少;由图 10可知,沉铜渣的主要物相为CuS。
3 结论
1)铜锰渣H2SO4浸出较优工艺条件:H2SO4用量200 g/L,液固体积质量比7:1,温度80 ℃,时间2 h。该条件下,铜、钴、锌、锰的浸出率分别为99.81%、99.54%,99.07%,24.10%,铜锰渣中的铜、钴、锌已基本浸出,生成的MnO2浸出渣可直接用于工业生产。
2)酸浸液选择性沉铜较优工艺条件:Na2S2O3用量倍数2.0,反应时间90 min,反应温度70 ℃。该条件下,铜的沉淀率为99.99%,钴、锌、锰的沉淀率分别为0.26%,0.34%,0.29%,生成的CuS沉淀渣铜含量高达58.05%,可直接用于工业生产。与Na2S等传统硫化剂相比,使用Na2S2O3能间接提供S2-离子,避免H2S气体中毒及环境污染的同时,较好的保障了反应体系中S2-离子的均匀分布。
3)铜锰渣常压酸浸及Na2S2O3选择性沉铜技术对设备要求简单,便于操作,生产成本较低;铜回收率达到99.80%,沉铜后液可继续分离提纯有价金属。
-
表 1 模拟卤水料液主要成分及含量
Table 1 maincontent of the simulatedbrine liquid
成分 Rb+ K+ Na+ 浓度 /(molL-1) 0.0117 0.5128 4.3478 -
[1] . 张霜华.浅谈拓宽我国铷铯的应用领域[J].新疆有色金属,1998(2):43-47. http://www.cnki.com.cn/Article/CJFDTOTAL-XJYS199802010.htm [2] . 王威,曹耀华,高照国,等.铷、铯分离提取技术研究进展[J].矿产保护与利 用,2013(4):54-58. http://www.cnki.com.cn/Article/CJFDTOTAL-KCBH201304018.htm [3] . 张正斌.海洋化学原理和应用—中国近海的海洋化学[M].北京:海洋出版社,1999:24-26. [4] . 曹冬梅,张雨山,高春娟,等.提铷技术研究进展[J].盐业与化工,2011,40(5):44-47. http://www.cnki.com.cn/Article/CJFDTOTAL-HHYH201105016.htm [5] . 牛慧贤.铷及其化合物的制备技术研究与应用展望[J].稀有金属,2006,30(4):523-527. http://www.cnki.com.cn/Article/CJFDTOTAL-ZXJS200604020.htm [6] . Kumar A,Mohapatra P K,Manchanda V K. Extraction of cesium-137 from nitric acid medium in the presence of macrocyclic polyethers[J]. J Radioanal Nuel Chem,1998, 229(1):169-172. http://cn.bing.com/academic/profile?id=2113577794&encoded=0&v=paper_preview&mkt=zh-cn
[7] . Tanihara K. Composite ion exchangers of redox type for cesium separation Sorption-desorption—regeneration cycle with cupric ferroeyanide impregrmted.macroporous anion-exchange resins of strongly basic type[J]. J Radioanal Nud Chem,1995, 201(6): 509—519.
[8] . 刘雪颖,杨锦瑜,陈晓伟,等.t-BAMBP分离铷钾萃取机理及热力学函数研究[J].核化学与放射化学,2007,29(3):151-155. http://www.cnki.com.cn/Article/CJFDTOTAL-HXFS200703005.htm [9] . 杨锦瑜,古映莹,钟世安,等.以t-BAMBP萃取分离铷钾的研究[J].有色金属,2008,60(2):55-58. http://www.cnki.com.cn/Article/CJFDTOTAL-YOUS200802013.htm [10] . Fujii T,Nishizawa K. Isotope sepaiations of potassium and rubidium in chemicad exchange system with dicyclohexano-18-crown-6 [J].J.Radioanal.Nucl.Chem,2001,249(3):569.
[11] . Banerjee S,Mukhopadhyay K, Mukhopadhyay B,Lahiri S. Extraction separation of 86Rb from 85Sr in trace level with 18-crown-6 in nitrobenzene [J].J.Radioanal.Nucl.Chem,2002,252(1):157.
[12] . 杨玲,王林生,赖华生,等.不同稀释剂中t-BAMBP萃取铷铯的研究[J].稀有金属,2011, 35 (4):627-632. http://www.cnki.com.cn/Article/CJFDTOTAL-ZXJS201104027.htm [13] . 孟素青,李瑞琴,丁建跃,等.萃取法(t-BAMBP)提取卤水中铷、铯及其影响因素分析[J].中国井矿盐,2013,(6):12-14. http://www.cnki.com.cn/Article/CJFDTOTAL-ZJKY201306005.htm [14] . 卢智,安莲英,宋晋.t-BAMBP萃取法分离提取高钾卤水中铷[J].广东微量元素科学,2010,17 (1):52-56. http://www.cnki.com.cn/Article/CJFDTOTAL-GWYS201001013.htm [15] . Liu SM, Liu H H, Huang Y J, et al. Solvent extraction of rubidium and cesium from salt lake brine witht-BAMBP-kerosene solution[J]. Transactions of Nonferrous Metals Society of China,2015(1):329-334.
[16] . 陈正炎,陈富珍.t-BAMBP萃取铷、铯的相关因素研究[J].稀有金属,1995,19(4):245-247. http://www.cnki.com.cn/Article/CJFDTOTAL-ZXJS504.002.htm



 下载:
下载: